
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
查看答案和解析>>
科目: 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目: 来源: 题型:解答题
| 步骤 | 实验方案 | 实验现象(描述最后的) | 离子方程式 |
| ① | 先向试管中加入溴化钠溶液2ml,再加入4-5滴新制氯水,振荡后分两份,取一份又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为橙色 | Cl2+2Br-=Br2+2Cl- |
| ② | 取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为紫红色 | Br2+2I-=I2+2Br- |
| 结论 | 氧化性:Cl2>Br2>I2(非金属性:Cl>Br>I) | ||
查看答案和解析>>
科目: 来源: 题型:选择题
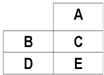
| A. | E的核电荷数大于B | |
| B. | A、C若为非金属,则对应氢化物的稳定性:A>C | |
| C. | B、D若为金属,其最高价氧化物对应水化物碱性:D>B | |
| D. | A一定是非金属元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用福尔马林对种子消毒不属于蛋白质变性 | |
| B. | 能用新制的氢氧化铜鉴别果糖与葡萄糖溶液 | |
| C. | 实验证实化合物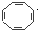 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| D. | 化合物的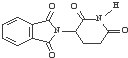 分子式为C13H8O4N2 分子式为C13H8O4N2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1 HA 中c(H+)=c(OH-)+c(A-), | |
| B. | 0.1mol•L-1 HA 与 0.1 mol•L-1NaOH 混合至溶液呈中性:c(Na+)<c(A-) | |
| C. | 0.1mol•L-1 NaA 中c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 0.1mol•L-1 HA中加入少量NaA固体,HA的电离常数减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| 实验Ⅱ | 取适量蓝绿色固体,加入足量稀硫酸 | 固体溶解,生成蓝色溶液, 产生无色气体 | 蓝绿色固体中含有C${{O}_{3}}^{2-}$ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com