
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 | |
| B. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 | |
| C. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| D. | 与稀盐酸反应的剧烈程度:M单质<X单质 |
查看答案和解析>>
科目: 来源: 题型:选择题
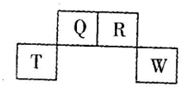
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中只有共价键没有离子键 | |
| D. | Q可形成多种含氧酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:D>C>B>A | |
| B. | 气态氢化物的热稳定性:HmB>HnC | |
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 | |
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22.4升(标准状况) |
查看答案和解析>>
科目: 来源: 题型:选择题
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
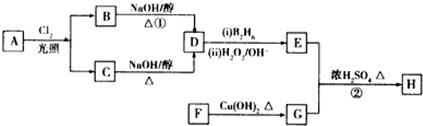
 .
. .
.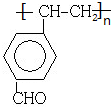 .
.查看答案和解析>>
科目: 来源: 题型:解答题
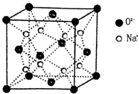 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.查看答案和解析>>
科目: 来源: 题型:解答题

| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com