
科目: 来源: 题型:选择题

| A. | t1时,只有正方向反应 | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,反应不再发生 | D. | t2~t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
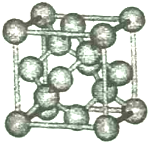 2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:
2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
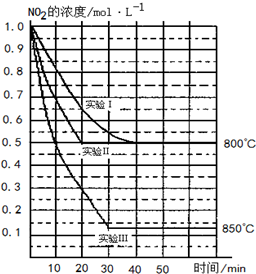 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 甲 组 | (A)C6H5OH (B)CH3COOCH3 (C)CH3=CHCOOH (D)CH3CH2Br |
| 乙 组 | ①溴水 ②FeCl3溶液 ③NaOH溶液 ④HCHO溶液 |
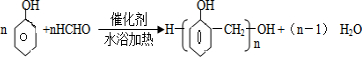 .
.查看答案和解析>>
科目: 来源: 题型:解答题
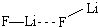 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO | |
| C. | 向0.1 mol•L-1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 | |
| D. | 向浓度均为1.0×10-3 mol•L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=n | B. | pH=-lg n | C. | pH=14-lgn | D. | pH=lgn+14 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 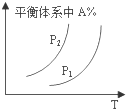 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 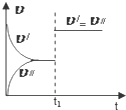 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 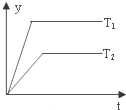 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
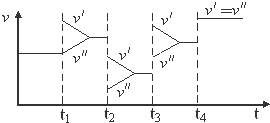
| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com