
科目: 来源: 题型:解答题
 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 浓度/mol.L-1 | NO | N2 | CO2 |
| 时间/min | |||
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.30 | 0.030 |
| 30 | 0.040 | 0.30 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
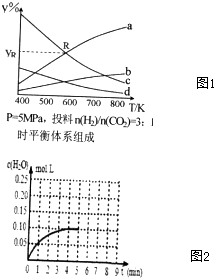
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
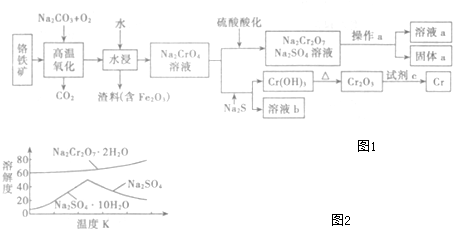
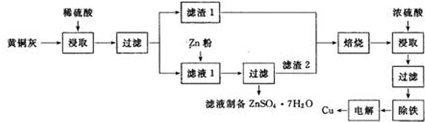 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.查看答案和解析>>
科目: 来源: 题型:解答题
 工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示:
工业上和净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为:CO(g)+H2O(g)?H2(g)+CO2(g).一定条件下,将4molCO与2molH2O(g)充入体积为2L的密闭容器中,体系中各物质的深度随时间变化如图所示:查看答案和解析>>
科目: 来源: 题型:填空题
| 时间/s | 5 | 10 | 15 | 20 | 25 |
| n(CO2)/mol | 0.04 | 0.06 | 0.07 | 0.08 | 0.08 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | 只有② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | NH4Cl溶于重水(D2O)生成NH3D2O和HD2O+ | |
| D. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com