
科目: 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目: 来源: 题型:解答题
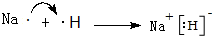 .
.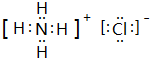 ,A2C2的电子式为
,A2C2的电子式为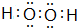 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 吸热反应需要加热后才能发生 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
查看答案和解析>>
科目: 来源: 题型:解答题

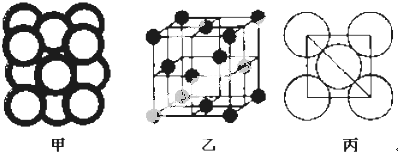
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 全部 | B. | ②③④⑤⑥ | C. | ④⑤⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 | ||
| C. | Na2O2固体中阴、阳离子 | D. | ${\;}_{1}^{2}$H原子中的质子和中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com