
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
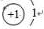 ,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H
,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H ,其中含有的化学键类型是离子键和共价键
,其中含有的化学键类型是离子键和共价键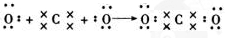 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: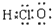 | |
| D. | NaCl的电子式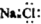 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述同位素中,Ti原子核中的中子数不可能为30 | |
| B. | 题述中包括5种钛原子,即钛元素的5种核素 | |
| C. | 根据题意可求得钛元素的平均相对原子质量为48 | |
| D. | 钛元素属过渡金属元素 |
查看答案和解析>>
科目: 来源: 题型:解答题

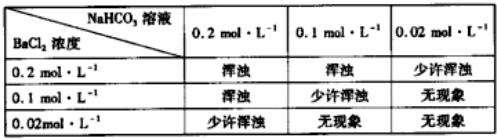
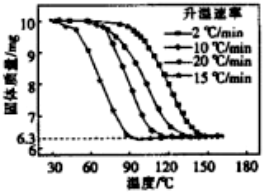
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com