
科目: 来源: 题型:选择题
| A. | 液溴保存时应加少量水并盛放在用玻璃塞塞紧的试剂瓶中 | |
| B. | 某气体通入品红溶液褪色,加热溶液又变红,该气体为SO2 | |
| C. | 配制硫酸亚铁溶液,可将绿矾晶体溶于蒸馏水并加入一定量的稀硫酸和铁屑 | |
| D. | 某溶液中加盐酸产生使澄清石灰水变浑浊的无色气体,则该溶液一定含CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
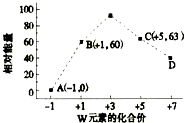 已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |
查看答案和解析>>
科目: 来源: 题型:选择题
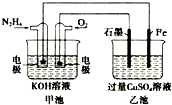
| A. | 甲池中负极上的电极反应式为N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨电极上发生的反应为4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH减小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2CO3 | C6H5ONa | 酸性:H2CO3>C6H5OH | |
| B | 液溴和苯 | 铁屑 | AgNO3溶液 | 液溴和苯发生取代反应 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐可以生成白色沉淀 | |
| D | 浓盐酸 | KMnO4 | FeBr2溶液 | 氧化性:Cl2>Br2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | H-F═H+F | B. | Mg+2H+=Mg2++H2↑ | ||
| C. | 2Na+2H2O=2Na++2OH-+H2↑ | D. | HNO3+NaOH=NaNO3+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | Li、Na、K的电子层数依次增多 | |
| D. | N、O、F得电子能力依次减弱 |
查看答案和解析>>
科目: 来源: 题型:解答题
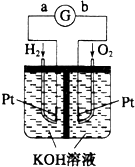 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用环形玻璃搅拌棒是为了加快反应速率,使其充分反应,减小实验误差 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 在测定中和热实验中需要使用的仪器有量筒、烧杯、胶头滴管、温度计等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com