
科目: 来源: 题型:多选题
| A. | K+、Na+、NO3-、CO32-在碱性溶液中能大量共存 | |
| B. | Na+ K+ OH- Cl-在强酸性溶液中能大量共存 | |
| C. | Cu2+、H+、NO3-、SO42-能形成无色透明的溶液 | |
| D. | Ba2+、Na+、Cl-、SO42-在溶液中不能大量共存 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | 还原剂为KClO3,氧化剂为I2 | ||
| C. | 还原性:I2>KIO3 | D. | 氧化性:KClO3>KIO3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 低于136K | B. | 高于409K | ||
| C. | 高于136K而低于409K | D. | 低于409K |
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验编号 | Fe2+溶液的 体积/mL | |||
| 1 | 20.00 | |||
| 2 | 20.00 | |||
| 3 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
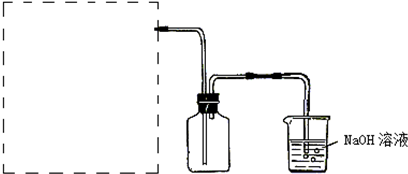
查看答案和解析>>
科目: 来源: 题型:解答题
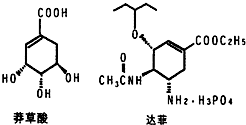 目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).
目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).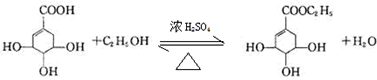 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com