
科目: 来源: 题型:
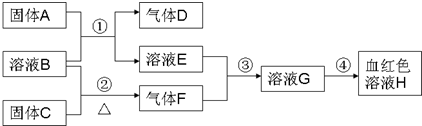
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
 ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)] | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| NO | - 3 |
查看答案和解析>>
科目: 来源: 题型:
关于氢原子电子云图,下列说法正确的是
A.一个小黑点代表一个电子
B.小黑点表示电子运动的轨迹
C.小黑点的疏密表示电子在核外空间出现的机会的多少
D.氢原子电子云是圆形的
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com