
科目: 来源: 题型:
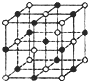 (2012?聊城一模)氯、氧、碳、铁是与人类生产生活息息相关的化学元素.
(2012?聊城一模)氯、氧、碳、铁是与人类生产生活息息相关的化学元素.查看答案和解析>>
科目: 来源: 题型:


| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
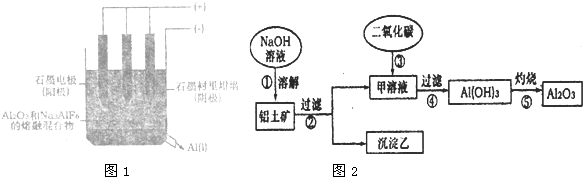
查看答案和解析>>
科目: 来源: 题型:

| ||
| 催化剂 |
| ||
| 催化剂 |
查看答案和解析>>
科目: 来源: 题型:
(2013?洛阳二模)已知298K时下列物质的溶度积(单位略)
|
查看答案和解析>>
科目: 来源: 题型:
 (2012?聊城一模)常温下,将0.1mol.L-1.盐酸逐滴加入到20mL0.1mol?L-1氨水中,测得溶液的pH随加入盐酸的体积变化如图所示.下列说法正确的是( )
(2012?聊城一模)常温下,将0.1mol.L-1.盐酸逐滴加入到20mL0.1mol?L-1氨水中,测得溶液的pH随加入盐酸的体积变化如图所示.下列说法正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com