
科目: 来源: 题型:选择题
| A. | 取代 加成 水解 | B. | 消去 加成 水解 | C. | 水解 消去 加成 | D. | 消去 水解 取代 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
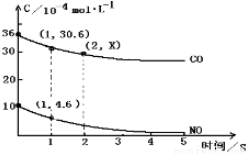
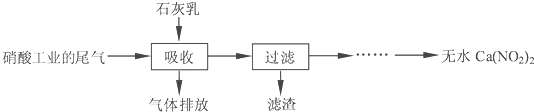
查看答案和解析>>
科目: 来源: 题型:解答题
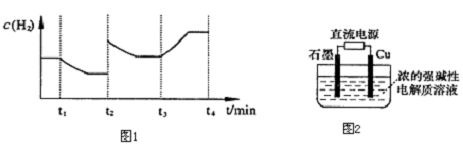
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  分离碘酒中的碘和酒精 | B. | 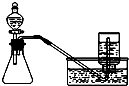 用铜和浓硝酸制取少量NO2 | ||
| C. | 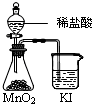 比较MnO2、Cl2、I2的氧化性 | D. | 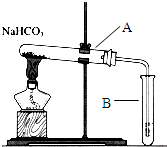 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA | |
| B. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 在电解食盐水的实验中,测得阴极析出的气体的分子数为0.5NA,则电解后溶液的pH为14 | |
| D. | 64g的铜发生氧化还原反应,一定失去2NA个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com