
科目: 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 用pH试纸测得某新制氯水的pH为2 | |
| C. | 有单质生成的反应一定为氧化还原反应 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:填空题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硝酸、氯水保存在棕色试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的金属钠存放于煤油中 |
查看答案和解析>>
科目: 来源: 题型:解答题
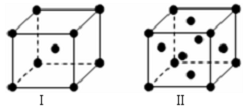 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题:
X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题:
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
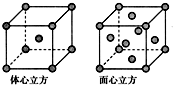 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
科目: 来源: 题型:选择题
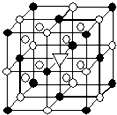 冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF6- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | SiO2晶体中存在四面体结构单元,O处于中心,Si处于4个顶角 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com