
科目: 来源: 题型:多选题
| A. | 容器内压强 | B. | 平均相对分子质量 | ||
| C. | 各组分浓度 | D. | 混合气体的颜色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 压强对该反应的平衡移动没有影响 | |
| B. | 在平衡体系中加入C,混合气体平均分子量增大 | |
| C. | 若正反应为吸热反应,则A为非气态 | |
| D. | 若正反应为放热反应,则A为非气态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图所示,若电解5 min时铜电极质量增加2.16g,试回答:
如图所示,若电解5 min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目: 来源: 题型:选择题
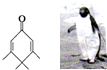 如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )| A. | 若与Penguinone互为同分异构体的酚类且苯环上只有两个取代基的有机物有9种 | |
| B. | Penguinone分子中所有碳原子可能处于同一平面 | |
| C. | Penguinone分子中无酚羟基所以不能使酸性高锰酸钾溶液褪色 | |
| D. | Penguinone分子式为C10H14O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com