
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题

| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解. |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目: 来源: 题型:填空题
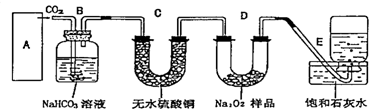
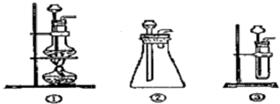
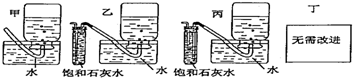
查看答案和解析>>
科目: 来源: 题型:解答题
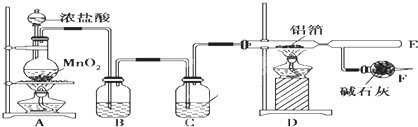
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 试用分液漏斗分液时,应将漏斗颈上的玻璃塞打开 | |
| B. | 蒸馏实验不一定使用温度计 | |
| C. | 用CCl4萃取碘水中的碘 | |
| D. |  过滤(如图)时,可将悬浊液从烧杯直接倒入漏斗中 过滤(如图)时,可将悬浊液从烧杯直接倒入漏斗中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作及其离子方程式 | 评价 |
| A | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | 正确 |
| B | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | 错误.溴乙烷不能电离出Br- |
| C | Ca(HCO3)2溶液与等物质的量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 错误.Ca2+与HCO3-的物质的量之比为1:2 |
| D | 氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com