
科目: 来源: 题型:选择题
| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热时生成白色的过氧化钠 |
查看答案和解析>>
科目: 来源: 题型:解答题
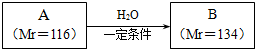
 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①⑤⑦ | C. | ③④⑤⑥ | D. | ②③④⑧ |
查看答案和解析>>
科目: 来源: 题型:解答题
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.图2是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.图2是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:查看答案和解析>>
科目: 来源: 题型:解答题
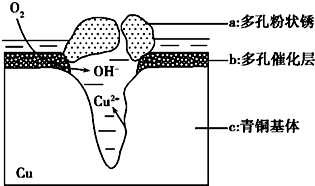 如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
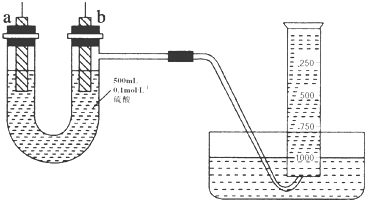
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com