
科目: 来源: 题型:填空题

 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: ;
; .
.查看答案和解析>>
科目: 来源: 题型:解答题
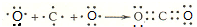 .
.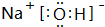 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.查看答案和解析>>
科目: 来源: 题型:解答题

 ,该分子的核磁共振氢谱有2种峰.
,该分子的核磁共振氢谱有2种峰.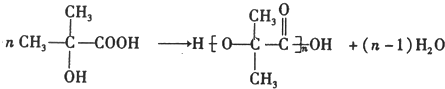 .F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.
.F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

 .家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O
.家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O .
.查看答案和解析>>
科目: 来源: 题型:解答题
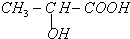 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图中所有的反应均为氧化还原反应 | |
| B. | 反应①②均为离子反应 | |
| C. | 反应②③都能产生氢气,且产生等量氢气消耗Al的质量和转移电子数分别相等 | |
| D. | 反应①②⑦中铝均作还原剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
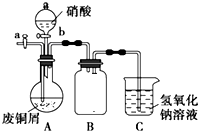 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图:查看答案和解析>>
科目: 来源: 题型:解答题
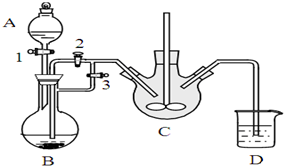 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com