
科目: 来源: 题型:选择题
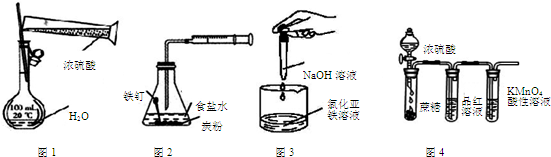
| A. | 用图1装置配制一定物质的量浓度的稀硫酸 | |
| B. | 用图2装置可探究铁的吸氧腐蚀 | |
| C. | 用图3装置可制取氢氧化亚铁 | |
| D. | 用图4装置可说明浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2 | B. | N2O | C. | NO | D. | NO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Fe3++2I-═2Fe2++I2 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2+3 H2O | D. | 3 Cl2+6 FeI2═2FeCl3+4FeI3 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BOH溶于水,其电离方程式是BOH═B++OH- | |
| B. | 若将一定量的上述溶液混合后pH=7,则c(A- )=c(B+) | |
| C. | 在0.1mol/L BA溶液中,c(B+)>c(A- )>c(OH- )>c(H+) | |
| D. | 若将0.1mol/L BOH溶液稀释至0.001mol/L,则溶液的pH=9 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com