
科目: 来源: 题型:选择题
| A. | 正极反应式:2CH3OH+2H2O-12e-═2CO2↑+12H+ | |
| B. | 放电一段时间后,负极的PH值升高 | |
| C. | 放电一段时间,阳离子向负极移动,阴离子向正极移动 | |
| D. | 该电池在工作时,每消耗32gCH3OH,外电路中通过6mole- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
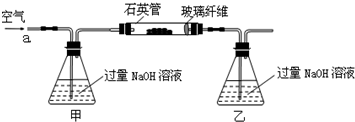

| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 将全部由短周期元素组成的化合物X加热分解,可得A、B、C、D、E和H2O六种产物,其中A、B、C都是中学化学中常见的氧化物,气体D是单质E所含元素的氢化物.
将全部由短周期元素组成的化合物X加热分解,可得A、B、C、D、E和H2O六种产物,其中A、B、C都是中学化学中常见的氧化物,气体D是单质E所含元素的氢化物.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| B. | 碱性溶液中:K+、Mg2+、S2-、ClO- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、SiO32-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
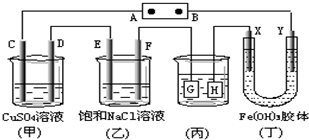
| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 |
查看答案和解析>>
科目: 来源: 题型:解答题
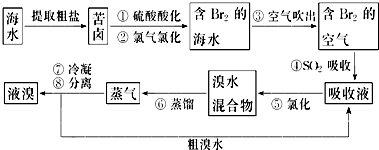
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com