
科目: 来源: 题型:选择题
| A. | 35Cl2、37Cl2、35Cl、37Cl | B. | -OH、-CH2OH、-CH2CH2OH | ||
| C. | CH4、CH3CH(CH3)2、(CH3)3CCH2CH3 | D. | 一氯甲烷、二氯甲烷、三氯甲烷 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C;
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C;查看答案和解析>>
科目: 来源: 题型:解答题
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.查看答案和解析>>
科目: 来源: 题型:解答题
 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.查看答案和解析>>
科目: 来源: 题型:选择题
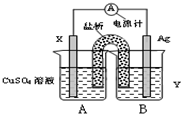
 如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )
如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )| a极板 | b极板 | Y电极 | c溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 石墨 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 方法 | 对相应方法的描述 |
| A | 改变金属内部的组成结构 | 此法实际上是将金属制成合金,增强抗腐蚀能力 |
| B | 在金属表面覆盖保护层 | 保护层破损后,就完全失去了对金属的保护作用 |
| C | 外加电流的阴极保护法 | 接外加直流电源构成电解池,被保护的金属作阴极 |
| D | 牺牲阳极的阴极保护法 | 构成原电池,被保护的金属作正极 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上制取Y的单质常用还原剂还原Y的氧化物 | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | 室温下,X的最高价氧化物的水溶液的pH>7 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 | |
| C. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com