
| A. | 工业上制取Y的单质常用还原剂还原Y的氧化物 | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | 室温下,X的最高价氧化物的水溶液的pH>7 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
分析 X、Y、Z是分别位于第2、3周期的元素,原子序数依次递增.Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z原子的最外层电子数是次外层电子数的一半,Z为Si元素,X与Z位于同一主族,则X为C元素.
解答 解:X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z原子的最外层电子数是次外层电子数的一半,Z为Si元素,X与Z位于同一主族,则X为C元素.
A.工业上电解熔融氧化铝冶炼Al,故A错误;
B.Z的最高价氧化物是二氧化硅,二氧化硅不与水反应,故B错误;
C.X的最高价氧化物的水溶液为碳酸溶液,溶液pH<7,故C错误;
D.Al在高温下可以与氧化铁发生铝热反应,可以置换出铁,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查元素化合物性质,注意常见既能与盐酸反应也能与NaOH溶液反应的物质.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ②④⑥⑦ | C. | ②⑥ | D. | ①③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
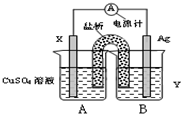 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO42-、MnO4- | ||
| C. | Na+、H+、NO3-、HCO3- | D. | Cl-、NO3-、Fe2+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:选择题
下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I3-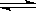 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com