
科目: 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验方法 | 现象 | 结论 |
| 向某溶液加入AgNO3溶液 | 出现白色沉淀 | 原溶液中一定有Cl- | |
| 向某溶液加入BaCl2溶液 | 出现白色沉淀 | 原溶液中一定有SO42- | |
| 向某溶液加入NaOH溶液 | 出现蓝色沉淀 | 原溶液中一定有Cu2+ | |
| 向某溶液加入H2SO4溶液 | 产生无色无味气体 | 原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将40g NaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成lL溶液 | |
| C. | 将1L 10mol/L的浓盐酸与9L水混合 | |
| D. | 20g NaOH固体溶解在水中配成500mL溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| T/℃ | 50 | 60 | 70 | 80 | 90 | |||
| c/mol•L-1 | 1.0 | 3.0 | 4.0 | 5.0 | 6.0 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在反应液中加入足量的稀盐酸 | 若溶液变浑浊且没有气体溢出(或:若没有气体溢出),则假设一成立;若溶液中有气体逸出,则假设一不成立 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢气通过灼热的氧化铜 H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | |
| B. | 二氧化碳通过Na2O2粉末 2Na2O2+2CO2═2Na2CO3+O2 | |
| C. | 铝与Fe2O3发生铝热反应 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 将锌粒投入Cu(NO3)2溶液 Zn+Cu(NO3)2═Zn(NO3)2+Cu |
查看答案和解析>>
科目: 来源: 题型:解答题
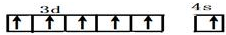 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.查看答案和解析>>
科目: 来源: 题型:解答题
 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1、2 | B. | 1、1 | C. | 2、1 | D. | 2、3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com