
科目: 来源: 题型:选择题
 有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )
有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )| A. | 到达平衡后,若使用催化剂,C的质量分数增大 | |
| B. | 平衡后,若升高温度,平衡则向逆反应方向移动 | |
| C. | 平衡后增大A的量,有利于提高A的转化率 | |
| D. | 化学方程式中一定是m+n<p+q |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  点燃洒精灯 | B. |  称量10.05g固体 | C. | 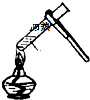 液体加热 | D. |  倾倒液体 |
查看答案和解析>>
科目: 来源: 题型:解答题


 ;
; +CH3CH(OH)CH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH(OH)CH2CH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O; .
.查看答案和解析>>
科目: 来源: 题型:解答题
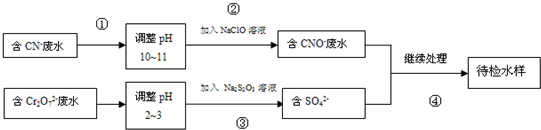
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
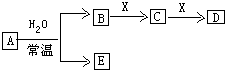 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去). ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{1}{2}$lg($\frac{b}{a}$) | B. | 14.3+lgb | C. | 14+$\frac{1}{2}$lg($\frac{a}{b}$) | D. | 14+$\frac{1}{2}$lg($\frac{b}{a}$) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com