
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
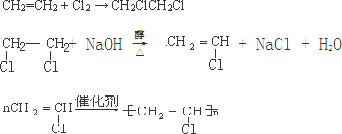 .
.查看答案和解析>>
科目: 来源: 题型:解答题
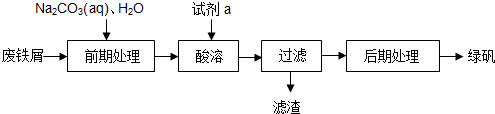
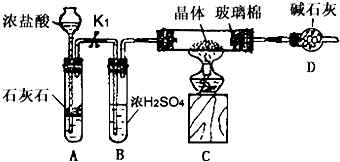
查看答案和解析>>
科目: 来源: 题型:填空题
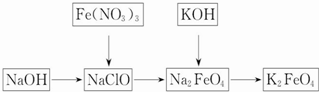
查看答案和解析>>
科目: 来源: 题型:填空题
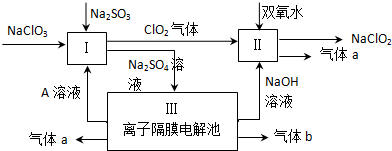
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

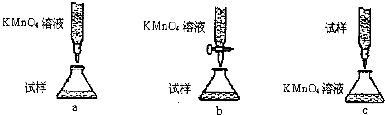
查看答案和解析>>
科目: 来源: 题型:解答题
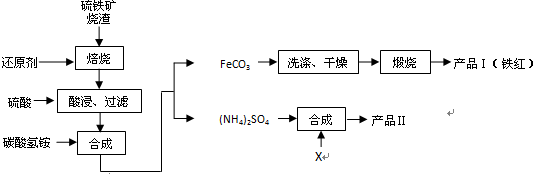
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com