
科目: 来源: 题型:填空题
 二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
 为了证明铜与稀硝酸反应产生一氧化氮,某校同学设计了一个 实验,其装置如图所示(加热装置和固定装置均已略去).
为了证明铜与稀硝酸反应产生一氧化氮,某校同学设计了一个 实验,其装置如图所示(加热装置和固定装置均已略去).查看答案和解析>>
科目: 来源: 题型:选择题
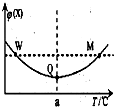 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )| A. | M 点时,Y 的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入 Z 达到新平衡时 Z 的体积分数增大 | |
| D. | W,M 两点 Y 的正反应速率相等 |
查看答案和解析>>
科目: 来源: 题型:多选题
 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )| A. | T1<T2,平衡常数 K1<K2 | |
| B. | 达到平衡时 A2 的转化率大小为 b>a>c | |
| C. | a、b、c 三点的平衡常数 Kb>Ka>Kc | |
| D. | 达到平衡时,AB3 的物质的量大小为 c>b>a |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 装置①中,电流计读数为零后,在甲中溶入 FeCl2固体,乙中的石墨电极为正极 | |
| B. | 装置②中,外电路通过 1mol 电子时,铜片质量减轻 64g | |
| C. | 装置③是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
科目: 来源: 题型:选择题
 ( )
( )| A. | 根据图①可判断正反应的△H<0 | |
| B. | 图②可表示压强(p)对反应 2A(g)+2B(g)?3C(g)+D(s)的影响,P2 的压强大 | |
| C. | 图③可以表示的反应为 2A(g)+B(g)?C(g)△H<0 | |
| D. | 图④表示一定条件下,在绝热、恒容的密闭体系中进行的反应:NO(g)+NO2(g)?N2O3(g)△H<0,t1 时刻达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡常数减小 | B. | CaO 的量不变 | C. | CO2浓度不变 | D. | CO2 浓度增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
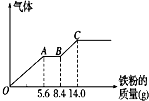 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 整个系统实现了物质零排放及能量间的完全转化 | |
| B. | 燃料电池的负极反应式为 H2+2OH--2e-═2H2O | |
| C. | 水电解系统中加入 Na2SO4 可增加溶液导电性 | |
| D. | 该系统的总反应式为 2H2+O2$?_{充电}^{放电}$2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com