
科目: 来源: 题型:选择题
| A. | CO2的分子模型示意图: | |
| B. | 氯化铵的电子式: | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p4 | |
| D. | NH3、H2O、CO2、HCl四分子中孤电子对最多的是CO2 |
查看答案和解析>>
科目: 来源: 题型:解答题
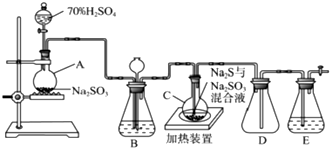
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将SO2通入酸性高锰酸钾溶液中,溶液褪色,不能说明SO2具有漂白性 | |
| B. | 浓盐酸和浓硫酸暴露在空气中浓度都会降低,其原因相同 | |
| C. | 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- | |
| D. | 土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三种气体的分子数目一定相等 | B. | 三种气体物质的量之比为16:2:1 | ||
| C. | 三种气体的密度之比为1:2:16 | D. | 三种气体的压强一定相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com