
科目: 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氨水 | 氯水 | 硫酸 | 醋酸 | 干 冰 |
| B | 氧化铁 | 盐酸 | 硫酸钡 | 亚 硫酸 | 二氧化硫 |
| C | 胆矾 | 碘酒 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 氯化氢 | 氢氧化钠溶液 | 氯化钠 | 磷酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY-的水解方程式:HY-+H2O?H3O++Y2- | |
| C. | 该酸式盐溶液中粒子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H2Y)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | FeCl3 | HBr | H3PO4 | Cu(OH)2 |
| 弱电解质 | CH3COOH | HF | BaSO4 | HI |
| 非电解质 | Cu | NH3 | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃的条件下△H不相同 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 任何放热反应在常温下都能发生 | |
| D. | 化学反应的反应热可通过反应物的键能之和减去生成物的键能之和求得 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
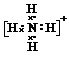 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目: 来源: 题型:解答题

| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
 和
和 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
. 、
、 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第2周期ⅢA族 | B. | 第2周期ⅥA族 | C. | 第3周期ⅤA族 | D. | 第3周期ⅢA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com