
科目: 来源: 题型:选择题
| A. | σ键是由两个p电子“肩并肩”重叠形成的 | |
| B. | σ键和π键都是共价键,σ键比π键更稳定 | |
| C. | 乙烯分子中的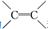 和乙炔分子中的-C≡C-都是π键 和乙炔分子中的-C≡C-都是π键 | |
| D. | H2分子中含有σ键,HCl分子中含π键 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 元素符号 | a | b | c | d | e | f | g | h |
| 原子半径/mm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合计 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
| 族/周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeO溶于稀硝酸中:FeO+2H+=Fe2++H2O | |
| B. | 过量氨水加入AlCl3溶液中:Al3++3OH-=Al(OH)3↓ | |
| C. | 金属钠溶于水中:Na+H2O=Na++OH-+H2↑ | |
| D. | 过量CO2通入NaOH溶液中:OH-+CO2=HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )
如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )| A. | 铁钉表面发生的反应为Fe-3e-=Fe3+ | |
| B. | 若液体a为稀盐酸,则U形管液面右高左低 | |
| C. | 若液体a为食盐水,则U形管液面左高右低 | |
| D. | 若液体a为食用油,则铁钉生锈速率较慢 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| B. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铜 | |
| C. | 将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 | |
| D. | 过量的铜与浓硝酸反应,生成的气体只有NO2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是:
物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在水电离出的c(H+)=1×10-13mol/L的溶液中下列离子一定能大量共存:Na+、CO32-、Cl-、K+ | |
| B. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 | |
| C. | K2SO3溶液中c(K+)与c(SO32-)之比为2:1 | |
| D. | 硫酸是强电解质,故纯硫酸能导电 |
查看答案和解析>>
科目: 来源: 题型:填空题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅胶可用作食品干操剂 | |
| B. | P2O5不可用作食品干操剂 | |
| C. | 六水氯化钙可用作食品干燥剂 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com