
科目: 来源: 题型:
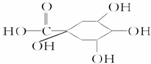
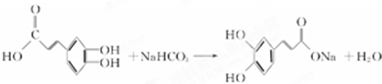
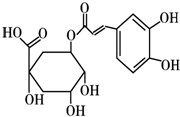 (2012?长春三模)[化学-选修 有机化学基础]注射用双黄链以绿原酸为主要成分(其结构如图)绿原酸有广泛的药理作用.
(2012?长春三模)[化学-选修 有机化学基础]注射用双黄链以绿原酸为主要成分(其结构如图)绿原酸有广泛的药理作用.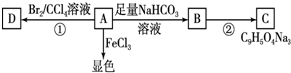


| a |
| 112 |
| b |
| 90 |
| a |
| 112 |
| b |
| 90 |
查看答案和解析>>
科目: 来源: 题型:
 (2012?长春三模)[化学-选修 物质结构与性质]A、B、C、D、E、F为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2形化合物,F原子核外最外层只有1个电子,其余各层均充满电子.
(2012?长春三模)[化学-选修 物质结构与性质]A、B、C、D、E、F为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2形化合物,F原子核外最外层只有1个电子,其余各层均充满电子.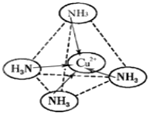

查看答案和解析>>
科目: 来源: 题型:阅读理解
| 催化剂 |
| △ |
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
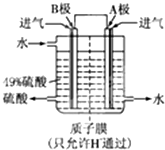
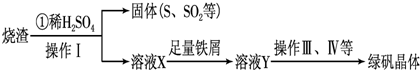
| O | - 4 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 (2012?长春三模)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
(2012?长春三模)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com