
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
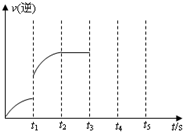 (2012?河东区一模)一定温度下在体积为5L的密闭容器中发生可逆反应.
(2012?河东区一模)一定温度下在体积为5L的密闭容器中发生可逆反应.| c(CO)?c(H2) | c(H2O) |
 CO(g)+H2(g)
CO(g)+H2(g) CO(g)+H2(g)
CO(g)+H2(g)查看答案和解析>>
科目: 来源: 题型:阅读理解

| 催化剂 |
| 紫外光 |
| 催化剂 |
| 紫外光 |
| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | 紫色石蕊试液B中溶液呈碱性(NaOH足量),无法证明是甲酸(酸性) 紫色石蕊试液B中溶液呈碱性(NaOH足量),无法证明是甲酸(酸性) |
| 新制氢氧化铜 | B中可能溶有过量的甲醛,无法证明是甲酸中醛基 B中可能溶有过量的甲醛,无法证明是甲酸中醛基 |
查看答案和解析>>
科目: 来源: 题型:
某无色溶液能与镁粉作用产生氢气,此溶液中可能大量存在的离子组是........( )
A.K+、Ba2+、AlO2-、CO32- B.A13+、Fe3+、HCO3-、SO32-
C.Ca2+、H+、C1-、NO3- D.H+、Na+、Cl-、SO42-
查看答案和解析>>
科目: 来源: 题型:
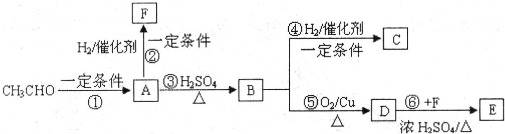
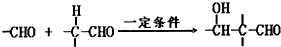
| 一定条件 |
| 一定条件 |
| 浓H2SO4 |
| △ |
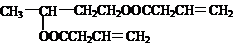
| 浓H2SO4 |
| △ |
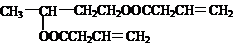
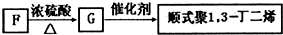
| 催化剂 |
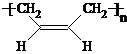
| 催化剂 |
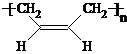
查看答案和解析>>
科目: 来源: 题型:

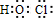
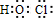
查看答案和解析>>
科目: 来源: 题型:
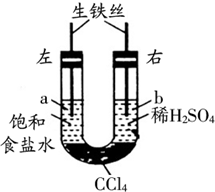 (2013?通州区二模)如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )
(2013?通州区二模)如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )查看答案和解析>>
科目: 来源: 题型:
(2012?河东区一模)下列实验设计不能达到预期目的是( )
|
查看答案和解析>>
科目: 来源: 题型:
(2012?河东区一模)已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确盼是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com