
科目: 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:选择题
“电芬顿法”除去水体里有机污染物的原理如图所示,发生电芬顿反应:Fe2++H2O2== Fe3++OH-+·OH,生成的羟基自由基(·OH)能降解有机污染物。下列说法正确的是
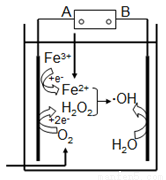
A. 电源的A极是正极,B极是负极
B. 阴极上O2、Fe3+、H2O2得电子发生还原反应
C. 阳极上发生电极反应:H2O-e-==•OH+H+
D. 常温常压下,消耗22.4LO2,可以产生4mol·OH
查看答案和解析>>
科目: 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:选择题
常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1HA溶液和HB溶液所得滴定曲线如图,下列说法不正确的是
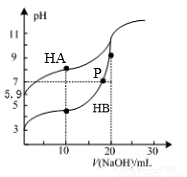
A. Ka(HA)=10-10.8
B. 滴定至P点时,溶液中:c(B-)+c(OH-)<c(HB)+c(H+)
C. 当滴定分别消耗l0mLNaOH 溶液时:c(B-)-c(A-)=c(HA)-c(HB)
D. 当滴定分别消耗20mLNaOH溶液时,将二种溶液混合:c(Na+)>c(B-)>c(A-)>c(H+)
查看答案和解析>>
科目: 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:填空题
废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是LiCoO2、铝、炭黑及其他杂质,回收利用的流程如下图。

已知“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
(1)写出步骤①中溶解铝的离子方程式:___________________,写出固体X到粗铝过程中所涉及的化学方程式:________________________。
(2)步骤②加入H2SO4和物质Y,物质Y可能为________(填序号)。
a.KMnO4溶液 b.稀硝酸溶液 c. H2O2溶液
写出步骤②中LiCoO2固体溶解的化学方程式:_______________________。
(3)实验表明溶液A中各种金属离子的沉淀虑随pH的变化如下图,现向溶液A中加入氨水,除去杂质离子________(填离子符合),应调节pH范围为_____________。
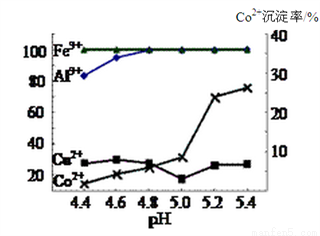
(4)母液中主要的溶质为_________________。
(5)从2kg锂离子电池正极材料(Li元素含量为7%)中可回收LiCO3的质量为_______g。(已知回收率为85%)
查看答案和解析>>
科目: 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:实验题
已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
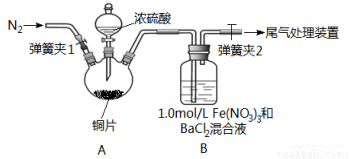
(i)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为_________________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加);假设1:装置A中白雾进入装置B中参与了反应;
假设2:______________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 (3)________________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生反应的离子方程式:_________________。
查看答案和解析>>
科目: 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。
(1)工业合成氨的热化学方程式是_________________。
(2)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
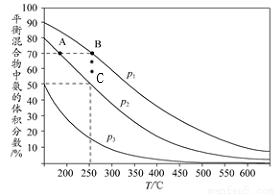
①由图可知:p1、p2、p3的大小关系为____________,理由是___________________。
②A、B点生成氨气的速率大小关系为____________________。B、C点,合成氨反应的化学平衡常数大小关系为__________,C点,N2的转化率为_____。③下列关于合成氨的说法正确是______(填序号)。
A.断开1个N=N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,你认为电解质溶液应显_______(填“酸性”“中性”或“碱性”),写出负极的电极反应式:_________。若电池产生的电流为1A,反应时间为1小时,氨气的转化率为80%,则最低需要______mol氨气(列出计算式即可,已知一个电子的电量是1.6×10-19C)。
查看答案和解析>>
科目: 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:填空题
A. B、C、D、E、R、G是元素周期表中前四周期元素,它们的原子序数依次增大。A与D可形成两种常见的液态化合物,B元素形成的化合物种类最多,E与其他元素不同族,E是日常生活中常见的金属元素,E的基态原子外围电子中成单电子数和成对电子数相等,R和C元素以1:1形成的化合物RC是一种新型半导体材料,G与C是同主族元素。回答下列问题:
(1) A与C、A与D形成的化合物中,既有极性键,又有非极性键的是_______ (用结构式表示)。
(2) 由A、C、D组成的离子化合物,阴离子中心原子的杂化轨道类型为_______;阳离子中化学键的键角______(填“大于”“小于”或“等于”)由相同元素组成的气体分子的键角,原因是__________________。
(3) E的基态原子核外电子排布共占据____个原子轨道,E(BD)5常温下为黄色油状液体,则E(BD)5的晶体类型是________,E(BD)5在空气中燃烧后剩余的固体呈红棕色,相应的化学方程式为__________________________。
(4) G的基态原子价电子排布图为_________,G的含氧酸中其阴离子为正四面体结构的是____ (填分子式)。
(5) RC在一定条件下水解,该反应的生成物为____________。
(6) Cu2+离子在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的 [Cu(NH3)4]2+离子,其原因是________________________。
(7) ①E的单质晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方堆积与面心立方堆积的两种E晶体的密度之比为__________(写出己化简的比例式即可)。
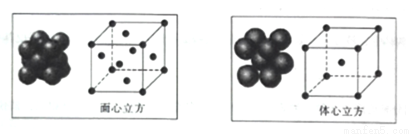
②RG与金刚石具有相似的晶体结构,已知G原子半径为a pm,R原子半径为b pm,列式表示G原子和R原子在晶胞中的空间占有率:________(用a、b表示)。
查看答案和解析>>
科目: 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:推断题
迷迭香酸(F)的结构简式为 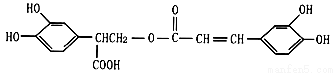 ,它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效。以A为原料合成F的路线如图23所示(已知笨环上的羟基很难直接与羧酸发生酯化反应)。
,它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效。以A为原料合成F的路线如图23所示(已知笨环上的羟基很难直接与羧酸发生酯化反应)。
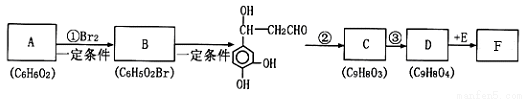
根据题意回答下列问题:
(l)A的结构简式为__________;反应②的反应类型是____________。
(2)D物质所含官能团的名称为_______________________。
(3)反应③的试剂为________________。
(4)l mol F与足量的溴水反应,最多可消耗Br2______mol,写出F与足量NaOH反应的化学方程式:___________________。
(5)E在一定条件下发生反应生成高聚物,若反应生成高聚物的平均相对分子质量为10000,则其平均聚合度约为_______(填序号)。
a.50 b.55 c.56 d.61
(6) R在分子组成上比E少一个碳原子且与E互为同系物。R的同分异构体中;
i.同时满足下列条件的有机物有______种(不含立体异构)。
①苯环上的一氯取代物只有一种;
②l mol R分别与NaHCO3、NaOH反应时,最多消耗NaHCO3、NaOH的量分别是1mol和4mol。
ii.R的同分异构体中,核磁共振氢谱有4组峰,且峰面积为3:2:2:1,写出其中一种异构体的结构简式:______________________。
iii.R的所有同分异构体在下列一种表征仪器中显示的信号(或数椐)完全相同,该仪器是___________(填序号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
化学科学与技术是改进生活,改善环境、促进发展的关键。下列说法正确的是
A. 制造“玉兔号”月球车太阳能电池帆板的材料是二氧化硅
B. “乙醇汽油”的主要成分都是可再生能源
C. “天宮”系列飞船使用的碳纤维材料、光导纤维都是新型无机非金属材料
D. 葡萄糖,蔗糖、油脂和蛋白质等营养物质在人体吸收后都能被水解
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是
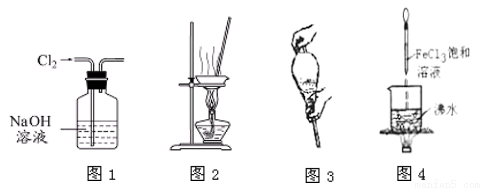
A. 用图1所示装置除去Cl2中含有的HCl
B. 用图2所示装置蒸干MgCl2饱和溶液制备MgCl2·6H2O晶体
C. 用环己烷萃取碘水时将两者混合后需如图3所示用力振荡
D. 继续煮沸图4所示溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
下列解释事实的离子方程式书写正确的是
A. 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
B. 氯化铁溶液吸收有毒的硫化氢气体:Fe3++H2S=2Fe2++S↓+2H+
C. SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O═BaSO3↓+2H+
D. 84消毒液和洁厕灵混合使用会产生有毒气体:5Cl-+ClO3-+6H+=3Cl2↑+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com