
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目: 来源: 题型:
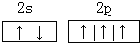

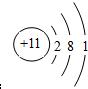

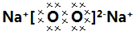
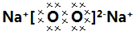
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
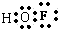
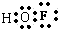
| H2 | O2 | F2 | OH | OF | HF | |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
查看答案和解析>>
科目: 来源: 题型:
 表示氢原子,
表示氢原子, 表示短周期的相邻的三种元素原子.小黑点表示没有形成共价键的最外层电子,短线表示共价键
表示短周期的相邻的三种元素原子.小黑点表示没有形成共价键的最外层电子,短线表示共价键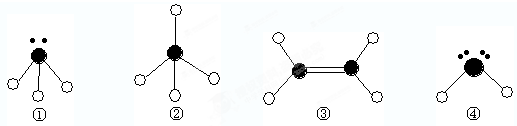
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com