
科目: 来源: 题型:






| 一定条件 |
 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O

 或
或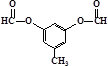
 或
或
 与G互为同分异构体
与G互为同分异构体查看答案和解析>>
科目: 来源: 题型:
 Ⅰ.下列实验操作不正确的是
Ⅰ.下列实验操作不正确的是| 乙醇 |
| 加热 |
| 乙醇 |
| 加热 |
查看答案和解析>>
科目: 来源: 题型:
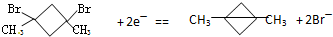
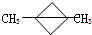 是
是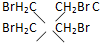 得到一种烃的电极方程式
得到一种烃的电极方程式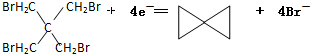
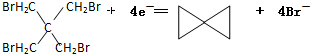
| 直流电 |
查看答案和解析>>
科目: 来源: 题型:
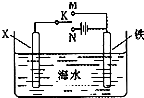 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | C-O | C≡O(CO) | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目: 来源: 题型:
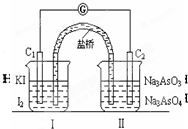 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com