
科目: 来源: 题型:
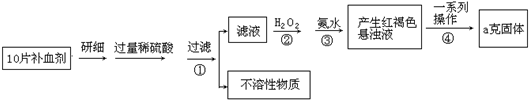
查看答案和解析>>
科目: 来源: 题型:
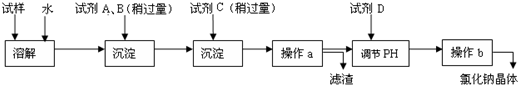
| ||
| ||
查看答案和解析>>
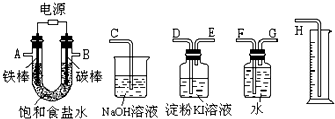
科目: 来源: 题型:阅读理解


| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目: 来源: 题型:

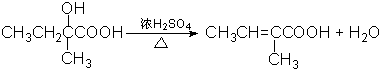

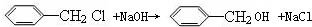
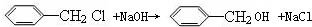




查看答案和解析>>
科目: 来源: 题型:
 (2012?西安一模)夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )
(2012?西安一模)夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com