
科目: 来源: 题型:
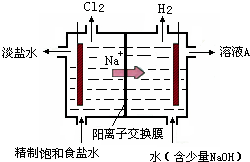
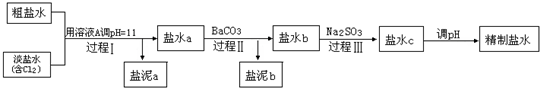
查看答案和解析>>
科目: 来源: 题型:阅读理解
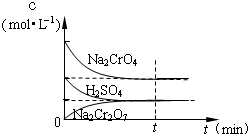 在25℃时,向Na2CrO4溶液中滴加稀硫酸,溶液由黄色转变为橙色,在此转化过程中,各物质浓度变化如图所示.写出转化过程中发生反应的离子方程式
在25℃时,向Na2CrO4溶液中滴加稀硫酸,溶液由黄色转变为橙色,在此转化过程中,各物质浓度变化如图所示.写出转化过程中发生反应的离子方程式查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |

| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | MnSO4 MnSO4 (填写所加甲固体的化学式) |
t |
查看答案和解析>>
科目: 来源: 题型:
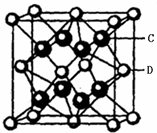 有A、B、C、D、E、M、X七种元素.其相关信息如下:
有A、B、C、D、E、M、X七种元素.其相关信息如下:| 相关信息 | |
| ① | A的基态原子2p轨道中有三个未成对电子 |
| ② | A、B元素的常见单质是构成空气的主要成分 |
| ③ | C是电负性最大的元素 |
| ④ | D是主族元素,基态原子有四个能层,且最外能层上只有两个电子 |
| ⑤ | D、E、M、X四种元素处于同一周期; M与E又位于同一族,M的原子序数比E多1,M的基态原子中含有三个未成对电子; X原子外围电子排布式为3d104s1 |
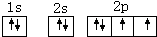

查看答案和解析>>
科目: 来源: 题型:
| ||
| 101KPa |
| ||
| 101KPa |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com