
科目: 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
反应ZnS(s) + C(s) + 2O2(g)=Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
(2)反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H﹤0
CO(NH2)2(s)+H2O(g)△H﹤0
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
若想提高氨气的转化率,可以采取的措施有 (写出两条)
(3)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
①700℃~980℃时发生反应中生成物质二氧化硫、ZnO和氧气,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,则这段时间二氧化硫的生成速率为 。
② 硫酸锌分解生成的SO2经下图中的循环可得到H2SO4。循环中电解过程阳极反应式是 。


查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

完成下列各题:
(1)正四面体烷的分子式为___________,其二氯取代产物有__________种。
(2)关于乙烯基乙炔分子的说法错误的是__________
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式: _____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修2:化学生活与技术]
分析下列水处理方法,完成下列问题:
(1)处理含Cr2O72-工业废水的工艺:
①工艺一:含Cr2O72-的工业废水![]() Cr3+、SO42-
Cr3+、SO42-![]() 。
。
为了进一步除去上述流程中生成的Cr3+,请你设计一个处理方案:________________。
②工艺二:向废水中加入过量的FeSO4溶液,经过一系列反应后,FeSO4溶液和Cr2O72-可形成铁氧体沉淀,从而除去铬元素。若使含1mol Cr2O72-的废水中的Cr2O72-完全转化为一种化学式为Cr0.5Fe2.5O4的铁氧体(其中的铬元素为+3价),理论上需要绿矾(FeSO4·7H2O)的质量不少于
g,上述得到的铁氧体中,Fe3+和Fe2+的个数之比 。
(2)如下是处理含氰(主要以CN—形式存在)废水工艺流程的一部分:
含氰废水![]() 。发生上述转化后CN—中碳元素转化为+4价,氮元素转化为0价,氯元素转化为-1价,若废水中CN—的浓度为300mg/L,含氰废水的流量为0.8m3/h,为保证安全,实际投放的ClO2为理论值得1.3倍,则为了完成上述过程每小时实际应该投入的ClO2的质量为__________kg(结果保留两位有效数字)。
。发生上述转化后CN—中碳元素转化为+4价,氮元素转化为0价,氯元素转化为-1价,若废水中CN—的浓度为300mg/L,含氰废水的流量为0.8m3/h,为保证安全,实际投放的ClO2为理论值得1.3倍,则为了完成上述过程每小时实际应该投入的ClO2的质量为__________kg(结果保留两位有效数字)。
(3)监测水中氯化物含量可采用硝酸汞滴定法,酸化的水样用硝酸汞滴定时可生成难电离的氯化汞,滴定到终点时过量的汞离子可与指示剂作用使溶液显示紫色。饮用水中的其他物质在通常浓度下对滴定不产生干扰,但水的色质、高价铁、六价铬、硫化物(如S2-)对实验有干扰。
①滴定前常用氢氧化铝悬浊液处理水样,其目的是__________________。
②若水中含有Cr2O72—,常在滴定前向水样中加入一定量的对苯二酚,其目的是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:

注:经检验黑色固体为Ag。
①白色沉淀的化学式是______________________。
②甲同学得出Ag+氧化了Fe2+的依据是_________________。

(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是______________________。
②b中电压表指针逆向偏移后,银为_______________极(填“正”或“负”)。
③由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:

①实验Ⅲ_________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_______________。
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法符合事实的是
A.物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,硫酸氢铵中的铵根离子物质的量浓度较小
B.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
C.物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后:c(X-)+ c(HX)= 0.02 mol/L
D.己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含C1-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀。
查看答案和解析>>
科目: 来源: 题型:
【题目】

(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
①A分子中的官能团名称是____________;
②A只有一种一氯取代物B,写出A的结构简式:____________;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种,F的结构简式是
______________________________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)____________________。
①加成反应 ②氧化反应 ③加聚反应 ④水解反应[
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到分子式为C10H12O2Na2的化合物。“TBHQ”的结构简式是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂.在实验室可用如图所示装置来制备1,2-二溴乙烷.其中试管c中装有浓溴水.

(1)写出制备1,2-二溴乙烷的化学方程式:_____________________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c是否发生堵塞。如果发生堵塞,a中的现象是:______.
(3)容器b中NaOH溶液的作用是______,相应的离子方程式为________________,可能发生反应的离子方程式为__________________________。
(4)将试管c置于冷水中,以及液溴表面覆盖少量水的原因是:____________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某大学实验室对煤矸石(主要含Al2O3、SiO2及Fe2O3)制备聚合氯化铝{[Al2(OH)nCl6-n]m(1≤n≤5,m≤10),简称PAC,是一种新型、高效的絮凝剂和净水剂}。其工艺流程如下:

请回答下列问题:
(1)用浓盐酸配制20%的盐酸所需的玻璃仪器有______________________________。
(2)加20%的盐酸酸浸,有关反应的离子方程式为_____________________________。
(3)残渣2的主要成分是,设计实验证明你的结论(填操作、现象):_____________________。
(4)由澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是_________________,得到的PAC粗产品中可能含有的杂质离子是____________。
(5)从不引入杂质的角度来考虑,调节溶液pH的试剂可改为________(填字母)。
A.NaOH B.Al C.氨水 D.Al2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1中的△H1>△H2
B. 对于可逆反应A(s)+3B(g)![]() 2C(g) △H>0,压强对平衡常数K的影响符合图2
2C(g) △H>0,压强对平衡常数K的影响符合图2
C. 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系
D. 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目: 来源: 题型:
【题目】I、白藜芦醇的结构简式如下图。它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性。下列有关白藜芦醇的说法正确的是
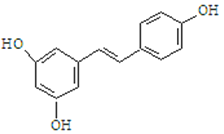
A.该有机物属于醇类
B.1mol该有机物与H2加成时最多消耗1mol H2
C.1mol该有机物与Br2反应时最多消耗6mol Br2
D.1mol该有机物最多消耗3mol NaOH
Ⅱ、根据下列的有机物合成路线回答问题:

(1)写出A、B的结构简式:A 、B 。
(2)写出各步反应类型:
① 、② 、③ 。
(3)写出②、③的反应方程式:
②
③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com