
科目: 来源: 题型:
【题目】碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。下列关于碳纳米管的说法不正确的是
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2O(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内的各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内的各组分的物质的量见下表
物质 物质的量 实验 | CO2 | H2 | CO | H2O |
甲 | a mol | a mol | 0mol | 0mol |
乙 | 2a mol | a mol | 0mol | 0mol |
丙 | 0mol | 0mol | a mol | a mol |
丁 | a mol | 0mol | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
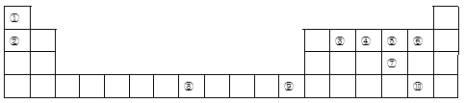
(1)比较①和②具有相同核外电子排布的简单离子半径大小关系为______________(填化学式);③、④、⑤三种元素的第一电离能由大到小的顺序为____________(填元素符号),写出原子序数和元素⑧相差2且元素⑧同族的元素基态原子的外围电子排布式____________。
(2)在元素③与①形成的原子个数比为1:1的四原子分子中,③原子的杂化方式为____________。其分子中δ键和π键数目之比为____________。
(3)元素④的某种氢化物甲分子中含有18个电子,甲为二元弱碱,在水中的电离方程式与氨相似。写出甲在水中的第一步电离的电离方程式____________。甲在微电子工业中,可作刻蚀剂H2O2的清除剂,二者发生反应的产物不污染环境,其化学方程式为____________。
(4)元素⑥和⑤形成分子乙的结构与元素①和⑤形成的最简单分子丙相似,乙的VSEPR模型为___________,解释丙的沸点高于乙的原因____________。
(5)可用赤血盐K3[Fe(CN)6]检验元素⑧的+2价阳离子,写出该反应的离子方程式___________,元素⑩的阴离子与元素⑧的+2价离子形成化合物丁,将3molCl2通入含4mol丁的溶液,用一个离子方程式表示该反应过程为____________。
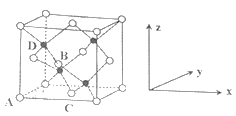
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为⑦和⑨组成的离子化合物戊的晶胞,其中三个离子(白色球)坐标参数A为(0,0,0);B为(,0,);C为(,,0)。则D离子(黑色球)的坐标参数为_____。
②晶胞参数,描述晶胞的大小和形状,已知戊的晶胞参数apm,则晶胞中B和D离子的距离为______pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与人类的生活息息相关,下列有关说法正确的是
A.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B.有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应制得的
C.SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料
D.因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料
查看答案和解析>>
科目: 来源: 题型:
【题目】《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对从地表渗出的、当地人称为“石脂”或“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松果不及也,此物必大行于世”的描述, 关于上文的下列说法中正确的是 ( )
A. “洧水”的主要成分是油脂 B. “洧水”的主要成分是煤油
C. “洧水”的主要成分是石油 D. 其烟的主要成分是石墨
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g) 在四种不同情况下的反应速率如下,其中表示反应速率最快的是
2C(g)+2D(g) 在四种不同情况下的反应速率如下,其中表示反应速率最快的是
A.v(A)= 0.15mol/(Lmin)
B.v(B)= 0.01mol/(Ls)
C.v(C)= 0.40mol/(Lmin)
D.v(D)= 0.45mol/(Lmin)
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
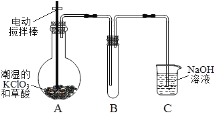
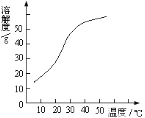
图1 图2
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。
已知Ⅰ.NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;
Ⅱ.NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④ ;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③原ClO2溶液的浓度为 g·L-1(用含字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:
CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) △H<0。
CH3OH(g) +H2O(g) △H<0。
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B.v正(CO2)=3v逆(H2)
C.容器内混合气体平均相对分子质量保持不变
D.容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com