
科目: 来源: 题型:
【题目】下列各物质的名称、化学式和分类均正确的是 ( )
A. 氧化钠(NaO)属于碱性氧化物 B. 硝酸钙(CaNO3)属于酸式盐
C. 硫酸(H2SO3)属于强酸 D. 乙醇(C2H6O)属于有机物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属冶炼的说法错误的是( )
A.绝大多数金属的冶炼主要依据氧化还原反应原理
B.工业上可利用铝热反应炼铁
C.金属铝的冶炼可采取电解熔融氯化铝的方法
D.金属冶炼常会消耗许多能量,也易造成环境污染
查看答案和解析>>
科目: 来源: 题型:
【题目】冰城哈尔滨的许多市民都喜爱滑雪,请填写下列空白:滑雪运动服的面料由____材料制成,具有______的特点(写两点)。去滑雪场时乘坐的是以CNG为标识的燃料汽车,其能量来源是________,则该燃料燃烧的反应的化学方程式是______________,反应前后碳元素的化合价分别为_______,在雪场周围的旷野上有许多废弃塑料饮料瓶,这些“白色污染”所带来的危害有________(写两点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(11分)请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1。则相同条件下破坏化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______________________。
HCO3-+OH-的平衡常数Kh=______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】开学前某同学去实验室打扫卫生发现,放假前做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,几位同学提出了自己的假设并展开了探究活动。

【猜想与假设】小松同学猜想:该溶液没有变质;小雷同学猜想:该溶液已变质
【表达与交流】小雷同学猜想的理由是(1)_____________________。
【实验验证】小松同学为了验正自己的猜想,取一定量试剂瓶中的液体于试管中,加入了少量的无色酚酞溶液,观察到溶液变成红色,于是认为自己的猪想正确。请对小松同学的结论做出评价(2)_______________。
小雷同学验证自己的猜想,取少量试剂瓶中的液体于试管中,加入了足量的稀盐酸,观察到溶液中有气泡产生,证实了溶液己经变质的猜想,写出有气泡产生的反应的化学方程式(3)_________________。
【验证与结论】小林同学和小文同学对已经变质的氢氧化钠溶液做了进一步探究,两位同学为了节约药品,将小松同学实验后的红色溶液平均分成两份于两只试管中,小林同学向其中一只试管中逐滴加入氢氧化钙溶液,观察到有白色沉淀生成,继续滴加至刚好不再产生沉淀时,发现溶液仍为红色,小林同学得出了该瓶溶液为部分变质的结论。请对小林同学的结论做出评价(4)______________________。
【反思与结论】小文同学向另一支试管中加入过量的一种溶液,观察到白色沉淀且溶液由红色变成了无色,准确证实了该瓶溶液已全部变质。请写出一种符合小文同学所加溶液的溶质的化学式(5)________。通过上述实验得出结论:在检验溶液中组成的实验操作中应注意的问题是(6)_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】达喜【AlaMgb(OH)c(CO3)d ·xH2O】常用于中和胃酸。
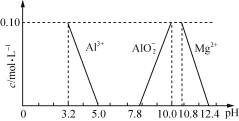
(1)1 mol达喜与足量的盐酸完全反应后生成水的物质的量为 mol(用含x等字母的代数式表示)。
(2)达喜化学式中a、b、c、d的关系为a+b c+d(填“>”、“=”或“<”)。
(3)已知在常温下溶液中Al3+、Mg2+、AlO2-的浓度与溶液pH的关系如上图所示。为测定达喜的组成,进行了下列实验:
① 取达喜6.02 g研碎,缓慢加入2.00 mol·L-1盐酸使其溶解,当加入盐酸85.00 mL时开始产生CO2,加入盐酸至90.00 mL时正好反应完全。
② 在①所得溶液中加入适量的 (填“氨水”、“氢氧化铝”或“氯化镁”)以调节溶液的pH至5.0~7.8,使有关离子完全沉淀。
③ 将②产生的全部沉淀过滤、洗涤,灼烧至恒重,称量为1.02 g。确定达喜的化学式为___________,并简要写出计算过程。
查看答案和解析>>
科目: 来源: 题型:
【题目】(9分)下图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精。已知D在标准状况下的密度为1.25g·L-1,其产量可以用来衡量一个国家石油化工发展水平。E是生活中常见的一种有机物。各物质间转化关系如下:
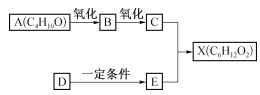
请回答下列问题:
(1)A的名称是_________,B中所含的官能团是________。
(2) C+E→X的化学反应类型是反应________。
(3)写出任意两种与A 具有相同官能团的A 的同分异构体的结构简式(不包括A ) :
(4)X与氢氧化钠溶液反应的化学方程式是________。
(5)以D为原料生产一种常见塑料的化学方程式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
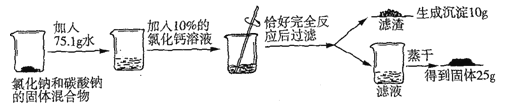
(1)写出上述反应的化学方程式_______________________;
(2)试列出求解混合物中碳酸钠的质量(x)的比例式_______________;
(3)原固体混合物中氯化钠的质量为_______________;
(4)反应后所得滤液中溶质的质量数为_______________;
(5)若工业上用此混合物239t与熟石灰混合制取含杂质的烧碱产品100t,则制得烧碱产品杂质含量为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com