
科目: 来源: 题型:
【题目】美国《探索》杂志报道:科学家对加拿大安大略湖北部的湖泊进行了研究,科学家们最终证实使死区“起死回生”的关键性因素是控制湖泊流域中的磷含量。综合上述信息,下列说法正确的是( )
①赤潮与水华都与氮、磷的富营养化有关
②海藻降解时会消耗水体中的氧气,导致水体缺氧,水生动物死亡
③早期使用的洗衣粉中添加的“Na5P3O10”,能除去自来水中的Ca2+和Mg2+等
④有科学家提出在南极播种铁质,促进藻类大量繁殖,其研究目的可能是扼制温室气体的增加
A.①②③④ B.①④
C.②③ D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是
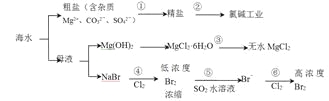
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】与c(H+)c(OH-)=Kw类似,FeS饱和溶液中c(Fe2+)c(S2-)=Ksp(FeS)。常温下Ksp= (FeS)=8.1×10-17
(1)理论上FeS的溶解度为_______g, 而事实上其浓度远大于这个数值,其原因可能__________。
(2)己知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+) c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到lmol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取4.42g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,灼烧后的残渣能与30mL盐酸恰好完全反应。试求:
(1)该白色粉末灼烧后产生气体在标准状况下的体积?
(2)原混合物中各物质的质量。
(3)所用盐酸的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:
【题目】
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接________;________接_______;b接_________(填接口编号)。

(2)A中常选用的固体反应物为_______________;D中应选用的液体为________________。
(3)第二步中让___________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________;装有无水CaCl2的U形管的作用是_________________________。
(5)第三步分离出NaHCO3固体的操作是________________。
(6)第四步中所加固体粉末化学式为 。所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3 kJ。
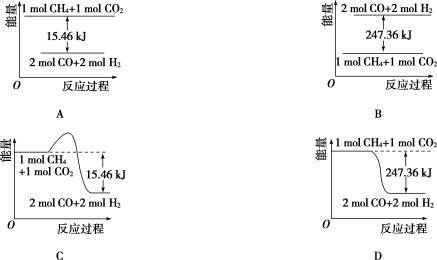
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。
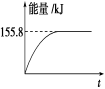
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为_________________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=______________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是______________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是

A. O2在电极b上发生还原反应
B. 反应消耗的NH3与O2的物质的量之比为4:5
C. 溶液中OH-向电极a移动
D. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语完全正确的一组是:( )
A.次氯酸电子式:![]() ,过氧化钠的电子式为:
,过氧化钠的电子式为:![]() ,羟基电子式为
,羟基电子式为![]()
B.KHSO4熔融电离:KHSO4=K++H++SO42-,KHCO3溶解于水,其电离:KHCO3=K++H++CO32-
C.高聚物化学式:聚异戊二烯 ,PVC
,PVC![]() ,PE
,PE![]()
D.下列分子式代表的有机物均有可能与 NaHCO3 反应放出 CO2:C5H12O2、C2H4O2、 C7H8O
查看答案和解析>>
科目: 来源: 题型:
【题目】A~H均为短周期元素,A~F在元素周期表中的相对位置如下图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G组成的气态化合物甲水溶液呈碱性。
A | B | C | |
D | E | F |
请回答下列问题:
(1)写出甲的电子式,实验室制取气体甲的化学方程式为。
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为。
A.离子键
B.极性键
C.非极性键
(3)请用电子式表示AE2的形成过程。
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序。
(5)用一个离子方程式解释A比D非金属性强的原因。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法中错误的是
A.14g乙烯和甲烷混合气体中的氢原子数一定大于2NA
B.2molN2与6molH2在一定条件下反应生成的NH3分子数一定大于2NA
C.56gFe溶于过量稀硝酸,电子转移数一定等于3NA
D.标准状况下,2.24LCH3Cl含有的共价键数一定等于0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com