
科目: 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】轻轨电车是近年来城市发展的一种无污染的新兴交通工具,当轻轨电车开动时,轻轨电车与架空电线的接触点由于高速摩擦会产生高温,因此接触点上的材料应该具有现耐高温,不易氧化,能导电的性质,你认为接触点上的材料应选用
A. 金刚石 B. 铝 C. 石墨 D. 铜
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,反应2SO2(g)+O2(g)= 2SO3(g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是
A. V(正)减小,V(逆)增大 B. V(正)增大,V(逆)减小
C. V(正)、V(逆)都减小 D. V(正)、V(逆)都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比( )
A.11:1 B.9 :1 C.1 :11 D.1 :9
查看答案和解析>>
科目: 来源: 题型:
【题目】各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是
A.用汽油除去衣服上的油污
B.用餐具洗洁精清洗餐具上的油污
C.用水洗去盘子中的水果渣
D.用醋洗去水壶的水垢
查看答案和解析>>
科目: 来源: 题型:
【题目】合理利用燃料减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )
A.“可燃冰”是将水变为油的新型燃料
B.氢气是具有热值高、无污染等优点的燃料
C.天然气、海洋能、太阳能、生物质能、风能、氢能 都属于新能源
D.电能是一次能源
查看答案和解析>>
科目: 来源: 题型:
【题目】为了区别CO(可能混有氧气)与CO2两瓶无色气体,下列方法中可行的是
A. 伸入燃着的木条。
B. 分别通入少量澄清石灰水,振荡。
C. 分别通入少量NaOH溶液,振荡。
D. 分别通入少量稀硫酸,振荡。
查看答案和解析>>
科目: 来源: 题型:
【题目】NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述中不正确的是( )
A. 降低压强能加快化学反应速率 B. 使用适当催化剂可以加快化学反应速率
C. 升高温度能加快化学反应速率 D. 增大压强可以加快此反应的速率
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 用肼(N2H4)还原新制Cu(OH)2 |
方法Ⅲ | 电解法:2Cu+H2O |
已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H = kJ·mol-1
(1)工业上很少用方法Ⅰ制取Cu2O是由于方法Ⅰ反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: 。
(2)方法Ⅱ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式:阴极 ;阳极 。

(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
序号 | Cu2Oa克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法Ⅱ | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法Ⅱ | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法Ⅲ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号)。
a.实验的温度T2小于T1
b.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
c.实验②比实验①所用的催化剂催化效率高
d.实验①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化锌吸收法常用作脱去冶金工业排放烟气中的SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s)+SO2(g)=ZnSO3(s),
试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②___________;
(2)已知:纯ZnO的悬浮液pH约为6.8.用氧化锌吸收法脱去烟气中SO2的过程中,测得pH随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
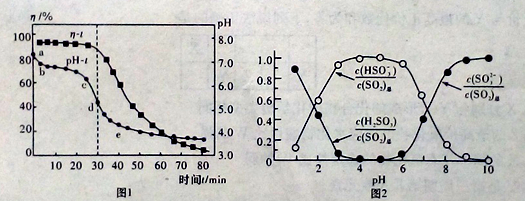
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________
③为提高SO2的吸收速率η,可采取的措施为 (填字母)。
A.调节悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(4)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
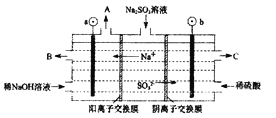
b极的电极反应式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com