
科目: 来源: 题型:
【题目】下列热化学方程式中ΔH表示可燃物燃烧热的是( )
A. CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ·mol-1
O2(g)=CO2(g) ΔH=-283 kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】用浓盐酸配制l∶l(体积比)的稀盐酸(约6mol/L)100mL,应选用的定量仪器
A. 量筒 B. 滴定管 C. 50mL容量瓶 D. 100mL容量瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】一个由n条多肽链组成的蛋白质分子共有m个氨基酸,该蛋白质分子完全水解共需多少个水分子( )
A. n个 B. m个 C. (m+n)个 D. (m-n)个
查看答案和解析>>
科目: 来源: 题型:
【题目】关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化合物的叙述不正确的
A. 纤维素是植物细胞壁的主要成分,它的单体(基本组成单位)是葡萄糖
B. 蛋白质是生命活动的主要承担者,它的单体是氨基酸
C. DNA是具细胞结构生物的遗传物质,它的单体是脱氧核苷酸
D. 磷脂是细胞膜的主要成分,只含有C、H、0三种元素
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸。
(1)H2O2在水中的电离方程式是__________________。
(2)H2O2常被称为“绿色”氧化剂的原因是____________________。
(3)向1 mol/L FeCl2溶液中滴加30%双氧水,除观察到双氧水分解产生的大量无色气泡外,还观察到浅绿色溶液逐渐变为红褐色,并测得其pH由反应前的3.69变为1.84。实验证明所得液体属于胶体,其方法是;_______,上述Fe2+被氧化成红褐色胶体的离子方程式是___________________。
(4)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
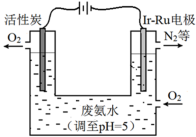
为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)__________c(NO3-)(填“>”、“<”或“=”)。
Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是___________________。
理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应mA(g)+nB(g) ![]() pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
A.化学计量数:m+n<p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
查看答案和解析>>
科目: 来源: 题型:
【题目】COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
A.①④⑥⑦ B.①④⑥ C.①②④⑦ D.③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1) Zn2+在基态时核外电子排布式为 。
(2) SO42-的空间构型是 (用文字描述)。
(3) PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3, CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是 。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下HCOOH沸点比CH3OCH3高,说明前者是极性分子后者是非极性分子
②1mo1PAN中含σ键数目为 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]S04,该配合物中心离子的配位数为 (填数字).
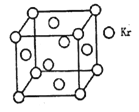
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n= (填数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

(1)该条件下反应平衡常数表达式K=______________;在t1 ℃时,反应的平衡常数为____________,达到平衡时n(CH3OCH3):n(CH3OH):n(H2O)=_____________________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”),反应向__________反应方向进行(填“正”或“逆”).。
Ⅱ.已知可逆反应:M(g)+N(g) ![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com