
科目: 来源: 题型:
【题目】粗盐的提纯实验中,下列操作错误的是()
A. 蒸发过程中用玻璃棒不断搅拌
B. 先用酒精灯加热蒸发皿,再将滤液倒入蒸发皿中
C. 当加热至蒸发皿中有较多固体析出时停止加热,利用余热将液体蒸干
D. 蒸发完成时,用坩埚钳把蒸发皿移至石棉网上
查看答案和解析>>
科目: 来源: 题型:
【题目】化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只有在强碱性条件下稳定,易被H2还原。
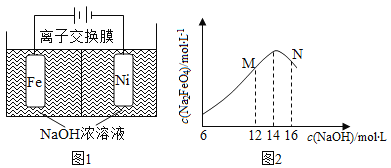
①电解一段时间后,c(OH-)降低的区域在__________(城 “阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有0.270 kg 质量分数为10 %的CuCl2溶液。计算:
(1)溶液中Cu2+ 和Cl-物质的量。
(2)若该溶液密度为1.08 g/mL,则CuCl2的物质的量浓度是多少?
(3)若取该溶液100 mL,加入铁片(过量),充分反应后对铁片洗涤、烘干、称重,铁片质量增加多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
I.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
V.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)简述由硫酸亚铁晶体得到FeSO4·7H2O的主要操作步骤:___________________。
(2)Ⅱ中,需加一定量硫酸。同理,配制硫酸铝溶液时也需加入一定量的硫酸,请说出加入硫酸的作用,并写出相关的离子方程式:________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是 ____________________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是____________________。
(4)IV中为什么用90℃热水洗涤沉淀?____________________。
(5)已知煅烧FeCO3的化学方程式是4 FeCO3+O2![]() 2Fe2O3+4CO2。现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则用氧气将这些FeO氧化需要标况下氧气的体积是_________L。
2Fe2O3+4CO2。现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则用氧气将这些FeO氧化需要标况下氧气的体积是_________L。
(摩尔质量/g·mol-1:FeCO3:116g·mol-1;Fe2O3:160g·mol-1;FeO:72g·mol-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是地球上含量丰富的一种元素。氮及其化合物在在工农业生产、生活中有着重要作用。
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
T/K | 298 | 398 | 498 |
平衡常数K | 4.1 x 106 | K1 | K2 |
如果合成氨反应的方程式写为![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
(2)下列能说明合成氨反应已达到平衡状态的是___________(填序号)。(反应是在固定体积的密闭容器中进行的)
A.容器内温度保持不变
B.v正(N2)=3v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
(3)合成氨工业中,按照勒夏特列原理,工业生产中应采用的条件为高压、低温,但事实上反应中并未采用较低的温度,原因是_____________________。
(4)硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业迅速发展,需要使用大量的硝酸。
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应的化学方程:________________________。
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。反应中的还原产物是_________________, 0.8mol Cu被硝酸完全溶解后,如果得到NO和NO2物质的量相同,那么标准状况下的气体体积为_________________L。(标况下NO和NO2视为气体)
查看答案和解析>>
科目: 来源: 题型:
【题目】有溶质的物质的量浓度均为0.1 mol/L的下列八种溶液①HCl ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是
A.②①③⑧⑦⑥⑤④ B.②①③⑥⑦⑧⑤④
C.①②③⑧⑦⑥④⑤ D.②①⑧③⑦⑥④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于过滤的叙述正确的是( )
A. 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈)
B. 过滤时把漏斗放在铁三脚架上
C. 过滤时将玻璃棒斜靠在三层滤纸上
D. 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体
查看答案和解析>>
科目: 来源: 题型:
【题目】1molL﹣1Na2SO4溶液的含义是( )
A.1L溶液中含142gNa2SO4
B.1L溶液中含有1molNa+
C.将142gNa2SO4溶于1L水中配成溶液
D.1L水中含有1molNa2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】水的离子积常数随温度升高而升高。关于一定量的水,下列叙述正确的是
A. 温度升高,水中分子总数减少 B. 水中c(OH-)随温度升高而降低
C. 水的pH随温度升高而升高 D. 水的电离过程是放热过程
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,两种气体的体积如果不同,其主要原因是( )
A.气体的物质的量不同 B.气体分子间的平均距离不同
C.气体的分子大小不同 D.气体的性质不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com