
科目: 来源: 题型:
【题目】置换反应是中学化学中常见的反应类型,其的通式可表示为:
单质甲+化合物A=单质乙+化合物B
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为空气中的一种主要成分,则该反应的化学方程式为 。
(2)若单质甲和化合物B均具有铁磁性,则该反应的化学方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B具有两性,则该反应的化学方程式为 。
(4)若单质乙是做光伏电池组件的重要材料,写出该反应的化学方程式 。
(5)若单质甲是金属,化合物A为一种温室效应气体,则该反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应2A(g)+ B(g)![]() 2C(g)+D(s) △H<0,一段时间后反应达到平衡。此反应过程中测定的数据如下表所示,则下列说法正确的是( )
2C(g)+D(s) △H<0,一段时间后反应达到平衡。此反应过程中测定的数据如下表所示,则下列说法正确的是( )
t/min | 2 | 4 | 6 | 8 | 10 |
n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率ν(C)=0.02mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)ΔH=+Q kJ·mol-1 (Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
Si(s)+4HCl(g)ΔH=+Q kJ·mol-1 (Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为Q kJ
C.将反应的温度由T1升高至T2,则对应温度下的平衡常数K1>K2
D.当反应吸收热量为0.25Q kJ时,生成的HCl恰好与1 mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列陈述均正确且Ⅰ、Ⅱ两者间有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 工业合成氨的反应在高温下进行 | N2+3H2 |
B | 明矾水溶液水解生成胶体 | 明矾可用于净水 |
C | SiO2是酸性氧化物 | HF溶液不能用玻璃试剂瓶盛放 |
D | 氯的非金属性比碘强 | 酸性:氢碘酸强于盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )
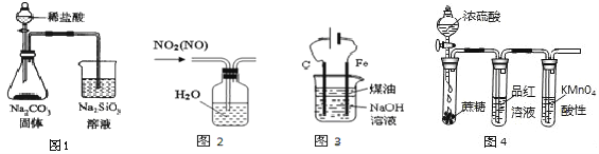
A.用图1实验可证明非金属性Cl>C>Si
B.用图2所示装置可除去NO2中的NO
C.用图3装置制备Fe(OH)2并能较长时间观察其颜色
D.图4实验装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2+O2![]() 2NO在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
2NO在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
A. 平衡向逆反应方向移动,N2和O2的转化率都减小
B. 平衡向正反应方向移动,N2和O2的转化率都增大
C. 压强增大平衡不移动,N2的转化率不变
D. 平衡向正反应方向移动,N2的转化率减小,O2的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.氢氧化钡溶液中加入硫酸:Ba2++OH—+H++SO42—=BaSO4↓+H2O
D.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+=CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com