
科目: 来源: 题型:
【题目】“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示。
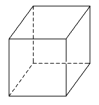
(1)立方烷的分子式为______________。
(2)该立方烷与氯气发生取代反应,生成的一氯代物有_________种,生成的二氯代物有____________种。
(3)若要使1mol该烷烃的所有氢原子全部被氯原子取代,需要_________mol氯气。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A. 苯在催化剂的作用下能与液溴发生取代反应
B. 在苯中加入酸性KMnO4溶液,振荡并静置后液体变为无色
C. 在苯中加入溴水,振荡并静置后下层液体为橙色
D. 苯的一氯取代物有3种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写正确的是( )
A.KClO3=K++3O2—+Cl5+ B.NaHCO3 = Na++H++CO32—
C.H2SO4=H++ SO42— D.Al2(SO4)3 = 2Al3++3SO42—
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。如图是制取溴苯的装置。试回答:
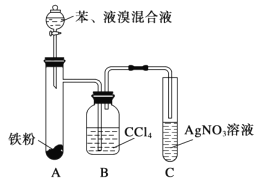
(1)装置A中发生反应的化学方程式是______________________。
(2)装置C中看到的现象是______________,证明________________。
(3)装置B是吸收瓶,内盛CCl4液体。如果没有B装置而将A、C直接相连,你认为是否妥当?__________(填“是”或“否”),理由是_____________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯_________(填“上”或“下”)层为溴苯,这说明溴苯___________且_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:H+ + HCO3- ![]() H2CO3
H2CO3 ![]() CO2 + H2O。故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是( )
CO2 + H2O。故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下若要使NH4Cl溶液中c(NH4+)/c(Cl-)比值增大,可采取的方法是
A.加少量水 B.加少量NaOH固体
C.加少量浓氨水 D.通入少量HCl气体
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,对于0.10mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,溶液的pH将_________(填“增大”“减小”或“不变”),这是因为__________。
(2)若向氨水中加入等体积pH=1的硫酸,此时溶液的pH_________7(填“>”“<”或“=”);用离子方程式表示其原因__________________;此时溶液中各离子浓度由大到小的顺序_________________。
(3)向氨水中加入0.05molL-1稀硫酸至溶液正好呈中性,则c(NH4+)________2c(SO42-)(填“>”“<”或“=”),此时混合溶液中c(NH4+)=176c(NH3·H2O),则NH3·H2O的电离常数Kb为__________。
(4)向10ml0.20mol·L-1的氨水中加入10ml 0.02mol·L-1的CaCl2溶液,通过计算说明是否会生成沉淀。Ca(OH)2的Ksp=5.5![]() 10-6氨水中c(OH-)≈
10-6氨水中c(OH-)≈![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G和J是元素周期表中前20号的主族元素,其原子序数依次增大。已知:
①A和D为同主族元素,且A的单质是最轻的气体;
②B元素最高价氧化物的水化物与其气态氢化物反应生成盐;
③F、G相邻,C的核电荷数是F核外电子数的一半,F与J可形成离子化合物J2F;
④E元素是地壳中含量最多的金属元素。
完成下列填空:
(1)ACD三种元素共同形成的化合物的电子式为____________,其微粒间存在的化学键有____________;将这种化合物滴入EG两种元素形成的化合物溶液中,直至过量,总反应的离子方程式为__________________。
(2)E元素位于周期表的第____________周期____________族。
(3)铜与B元素最高价氧化物的水化物的浓溶液反应的离子方程式为_________________。
(4)F、G分别与A形成的化合物,还原性强的是_______(填写相应的化学式)。
(5)F简单阴离子的结构示意图_______,且F、G、J简单离子的半径由大至小的顺序是_______(填写相应离子符号)
(6)实验室制取单质G的化学方程式为____________________________,
比较F、G的最高价氧化物的水化物的酸性(填写相应化学式)_______>_______。
(7)一种燃料电池,以铂为电极插入KOH溶液中,分别向两极通入A单质和C单质。通入C单质的一极是_______极,电极反应式为:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海藻中含有丰富的碘元素。下图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是( )
A.步骤④的操作是过滤
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤①、③的操作分别是过滤、萃取
D.步骤③中加入的有机溶剂乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com