
科目: 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
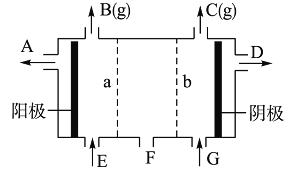
A.阳极反应式为2H++2e-=H2↑
B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H+通过
D.Na2SO4溶液从E口加入
查看答案和解析>>
科目: 来源: 题型:
【题目】对于溶液中的反应:2KMnO4+10FeSO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,下列措施能使化学反应速率提高的是( )
A.加水 B.增加同浓度FeSO4的用量
C.加压 D.加入少量KMnO4晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作及数据记录正确的是:
A、用量筒量取KMnO4溶液12.00mL
B、测定中和热时将NaOH溶液迅速一次性倒入盛有盐酸的小烧杯中,盖好盖板
C、常温下,测得0.01mol/LNaHCO3溶液的pH值=12
D、加热蒸发FeCl3溶液,获得FeCl3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】由于燃料电池汽车,尤其氢燃料电池汽车可以实现零污染排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,燃料电池汽车成为近年来汽车企业关注的焦点。为了获得竞争优势,各国纷纷出台政策,加速推进燃料电池关键技术的研发。燃料电池的燃料选择有氢气、甲醇等。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) ΔH=-285 kJ·mol-1①
CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1②
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:________________________。
(2)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的正极发生的反应是______________;负极发生的反应是________________。
②在稀土氧化物的固体电解质中,O2-的移动方向是______________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车。主要原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯产量是衡量一个国家石油化工发展水平的标志.下列关于乙烯说法正确的是( )
A.与乙烷互为同分异构体
B.分子中存在C≡C
C.能使酸性高锰酸钾溶液褪色
D.分子中存在C=O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu
B.氢氧化钠溶液与盐酸反应:OH﹣+H+═H2O
C.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
D.氯化钡溶液与稀硫酸反应:Ba2++SO42﹣═BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于原电池的叙述正确的是( )
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池放电时,电流的方向是从正极到负极
C. 比较不活泼的金属为负极
D. 在原电池中,电子流出的一极是负极,该电极被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下重水中存在电离平衡D2O![]() D++OD﹣,D2O的离子积常数为1.0×10﹣12,若pD=-lgc(D+),该温度下有关分析不正确的是( )
D++OD﹣,D2O的离子积常数为1.0×10﹣12,若pD=-lgc(D+),该温度下有关分析不正确的是( )
A.0.1molNaOD溶于重水制成1L溶液,pD=13
B.将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6
C.向30mL0.5mol·L﹣1NaOD的重水溶液中加入20mL0.5mol·L﹣1 DCl的重水溶液,所得溶液pD=11
D.pD=10的NaOD的重水溶液中,由重水电离出的c(OD﹣)为1×10﹣10mol·L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com