
科目: 来源: 题型:
【题目】下图是元素周期表的一部分,用表中①~⑨的元素符号或物质化学式回答问题:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素⑥的原子的核外电子数为_______,原子的L层电子数是K层2倍的元素为
_______(填元素符号);
(2)化学性质最不活泼的元素原子的原子结构示意图为____________;
(3)①~⑧中,元素原子半径最大的是________(填元素符号),这些元素的最高价氧化物对应的水化物中,酸性最强的酸是________(填化学式);
(4)请写出元素⑤的过氧化物的电子式______________;
(5)用电子式表示元素②的氢化物的形成过程________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),已知电离平衡常数:CH3COOH>H2CO3>C6H5OH >HCO![]() ,其中不正确的是
,其中不正确的是
A.pH相等的四种溶液:a.CH3COONab.C6H5ONac.NaHCO3d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=4浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】 在一定温度条件下,对于已达平衡的反应:FeCl3+3KSCN![]() 3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是( )
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是( )
A.加入少量氯化钾固体 B.加入少量氯化铁固体
C.只减少Fe(SCN)3的浓度 D.加水稀释
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是( )
A. 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物
B. 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
C. 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
D. 煤经过气化和液化两个物理变化,可变为清洁能源
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F六种物质的转化关系如右图所示 (反应条件和部分产物未标出)
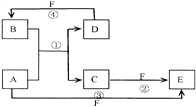
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的离子结构示意图为__________,D的元素名称为__________,反应④的化学方程式为_________________________;
(2)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,A元素原子核外最外层电子数是内层电子数的2倍,则A、D、F三种元素按原子半径由大到小顺序排列为_________________________;(用元素符号表示)
反应①的化学方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿佛加德罗常数的值,下列叙述中正确的是 ( )
A.22.4L标况下的氯气在化学反应中转移的电子数一定为2NA
B.在1L pH=12的K2CO3溶液中由水电离产生的OH-数目为0.01NA
C.14g由N2与C2H4组成的混合气体中含有的氢原子数可能为2NA
D.22.4L标况下的CO2中共用电子对数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
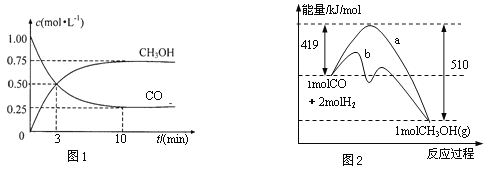
(1)图1是表示一定温度下,在体积为2 L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率 v(CO)=_____________;H2的平衡转化率为_______________。
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式:______________。
(3)该温度下,反应平衡常数K=______________(填数值)。
(4)恒容条件下,下列措施中能使反应体系中![]() 增大的措施有____________。
增大的措施有____________。
A.升高温度 B.充入He气 C.再充入2molH2 D.使用催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
在海洋碳循环中,通过右图所示的途径固碳。

①写出钙化作用的离子方程式:______ ______________。
②同位素示踪法证实光合作用释放出的O2只来自于H2O。 用18O标记光合作用的化学方程式如下,将其补充完整。
__________+__________![]() (CH2O)x+x18O2+ xH2O)
(CH2O)x+x18O2+ xH2O)
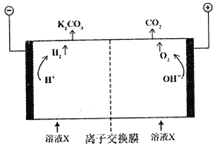
(2)工业上常用高浓度K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,并将CO2富集,其装置如下图。在阳极区发生的反应包括_________和H++HCO3-=H2O+CO2↑。简述CO32-在阴极区再生的原理:______________。
(3)将上述富集的CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径。合成气用干制备甲醇的反应为:2H2(g) +CO (g) ![]() CH3OH(g) △H=-90.l kJ/mol
CH3OH(g) △H=-90.l kJ/mol
在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表。

根据上表信息填空(填写“>”“< ”或“=”):
2c1_________c3;②|x|+|y|___________90.1;
③2p2_________p3;④α1+α2_________1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是

A. X和Z氢化物的热稳定性和还原性均依次减弱
B. R、W和氢三种元素形成的阴离子有2种以上
C. RY2分子中每个原子的最外层均为8电子结构
D. R、Y、Z的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com