
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.32 g O2所含的原子数目为NA
B.0.5 mol H2O含有的原子数目为1.5 NA
C.1 mol SO2含有的SO2分子数目为NA
D.0.5 NA个Cl2的物质的量是0.5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑤⑥ B.①② C.②③⑤ D.②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
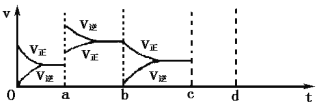
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
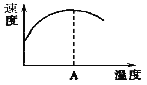
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,上图右表示酶参加的反应中温度与反应速率的关系,解释曲线变化原因 。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:
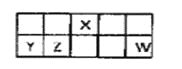
(1)写出W的离子结构示意图________________
(2)比较W 与Z的最高价氧化物对应水化物酸性的强弱 (写化学式)
(3)写出X的氢化物的电子式 ,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式_____________________
(4)已知:①C(s)+ O2(g)= CO2(g) △H="a" kJ· mol-1;
②CO2(g) +C(s)="2CO(g)" △H="b" kJ· mol-1;
③Si(s)+ O2(g)=SiO2(s) △H="c" kJ· mol-1。写出工业生产中用碳粉还原二氧化硅制取粗硅的热化学方程式_________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氨气的说法正确的是
A. 氨既能用浓硫酸干燥也能用无水CaCl2干燥
B. NH3是电解质,所以氨水能导电
C. NH3可以使干燥的红色石蕊试纸变蓝
D. 用水吸收NH3用如图装置可防止倒吸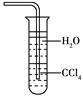
查看答案和解析>>
科目: 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是( )
A. 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B. 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C. 打开分液漏斗的活塞,使全部下层液体沿盛接液体的烧杯内壁慢慢流出
D. 最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2CO(g)=2C(s)+O2(g)。设△H和△S不随温度而变,下列说法中正确的是
A.低温下是能自发进行 B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行 D.任何温度下都不能自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:

(1)元素Z位于周期表中的位置_____________。
(2)在标准状况下,用充满X元素的氢化物气体及少量空气的混合气体的烧瓶做喷泉实验,实验结束后,则烧瓶中所得溶液的物质的量浓度为____________mol/L(结果保留两位有效数字)。
(3)W、Z的最高价氧化物对应的水化物的酸性大小顺序____________(用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为
_______________________________________。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图装置来验证卤族元素性质的递变规律。

据如图回答:
(1)甲同学设计实验的依据是____________________________________。
(2)写出选用的化学试剂:B____________,其作用为___________。
(3)C中反应的离子方程式为____________________________________________。
据如图回答:
乙同学的实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色。
(4)写出B处反应的离子方程式 ___________________________________________。
(5)A中验证氯气的氧化性强于碘的实验现象是_____________________。
(6)过程Ⅲ实验的目的是_________________________。
(7)综合甲、乙两同学的实验得出的结论是:同主族元素从上到下元素的非金属逐渐减弱,其原因是___________________________________________(试从原子结构角度解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K[来 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;再充入CO2气体,则平衡 移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K (选“增大”、“减小”或“不变”)。
(2)该反应的逆反应方向为 反应方向(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com