
科目: 来源: 题型:
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )

A. 简单离子半径大小关系为B3+>A2+
B. 气态氢化物的稳定性HD<H2C
C. 形成的简单离子的还原性E->D-
D. 最高价氧化物对应的水化物的酸性H2CO4>HEO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应进行分类时,既属于氧化还原反应又属于化合反应的是
A.CO2+H2O═H2CO3 B.2KClO3═2KCl+3O2↑ C.S+O2═SO2 D.2O3═3O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作不正确的是
A. 用量筒量取25.0mL蒸馏水 B. 用分液漏斗分离乙醇和水
C. 用烧杯溶解FeCl3固体试样 D. 用托盘天平称量NaCl固体5.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________,该反应为______反应(填吸热或放热)。[
若改变条件使平衡向正反应方向移动,则平衡常数_________(填序号)
①一定不变②一定减小③可能增大④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)(d)c(CO)=c(CO2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃[ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O(g)的物质的量是。
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”)。
③若实验C中达到平衡所需时间t3(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是

A. 甲为C2H5OH、X为O2 B. 甲为H2S、X为O2
C. 甲为HNO3、X为Fe D. 甲为AlCl 3溶液、X为NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA阿伏伽德罗常数的值。己知反应
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1="a" kJ/mol
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2="b" kJ/mol,其它数据如表:
化学键 | C═O | O═O | C-H | O-H |
键能kJ·mol-1 | 798 | x | 413 | 463 |
下列说法正确的是
A. 上表中 x=(1796+b)/2
B. H2O(g)═H2O(l) △S<0,△H═(a-b )kJ/mol
C. 当有4NA个C-H键断裂时,该反应放出热量一定为a kJ
D. 利用反应(1)设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极质量一定减轻6.4g
查看答案和解析>>
科目: 来源: 题型:
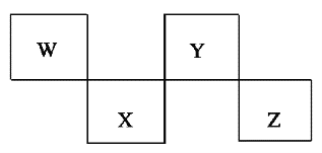
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是4种短周期元素,在元素周期表中的位置如下图所示,其中Z位于ⅦA族。下列判断错误的是( )
A. 常压下四种元素的单质中,W单质的熔点最高 B. Z的阴离子电子层结构与氩原子的相同
C. W的氢化物的沸点比Y的氢化物的沸点高 D. Y元素的非金属性比X元素的非金属性强
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为KNO3和NaCl的溶解度曲线,请回答下列问题:
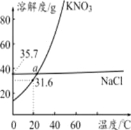
(1)20℃时, KNO3的溶解度为 。
(2)a点处KNO3和NaCl两种溶液中溶质的质量分数 (填“相等”或“不相等”)
(3)若固体KNO3中混有的少量NaCl,可采用 (填“蒸发结晶”或“降温结晶“)的方法提纯。
(4)40℃时,将35.0gNaCl溶于100g水中,降温至0℃时,可析出晶体 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com