
科目: 来源: 题型:
【题目】科学家在研究生物体的化学成分时,发现组成生物体的元素在非生物界中都存在,只是含量不同,以上事实主要说明
A. 生物界与非生物界没有差别
B. 生物来源于非生物
C. 生物界与非生物界具有统一性和差异性
D. 生物界与非生物界具有统一性
查看答案和解析>>
科目: 来源: 题型:
【题目】有关实验装置的说法中正确的是
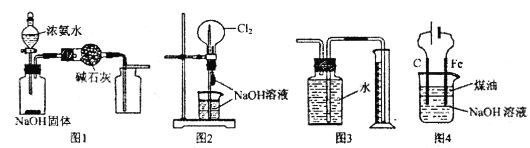
A. 图l装置可制取干燥纯净的NH3
B. 图2装置可以完成“喷泉”实验
C. 图3装置可测量Cu与浓硝酸反应产生气体的体积
D. 图4装置可用于实验室制备Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实。[18]-轮烯是一种大环轮烯,其结构简式如图所示。 有关它的说法正确的是
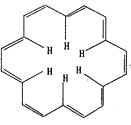
A. [18]- 轮烯分子中所有原子不可能处于同一平面
B. [18]- 轮烯的分子式为:C18H12
C. 1 mol[18]- 轮烯最多可与9 mol氢气发生加成反应生成环烷烃
D. [18]- 轮烯与乙烯互为同系物.
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
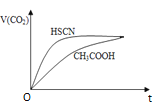
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
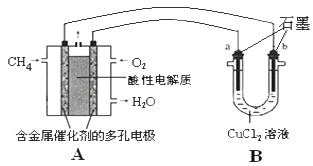
①甲烷燃料电池的负极反应式是____________
② 当A中消耗0.15mol氧气时.B 中____极增重_______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 乙醇和乙酸都存在碳氧双键 B. 甲烷和乙烯都可以与氯气反应
C. 高锰酸钾可以氧化苯和甲烷 D. 乙烯可以与氢气发生加成反应,苯不能与氢气加成
查看答案和解析>>
科目: 来源: 题型:
【题目】硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,在循环过程中价态变化在-2价至+6价之间,以不同的状态(或形态)发生一系列的变化,请分析此图并回答有关问题,
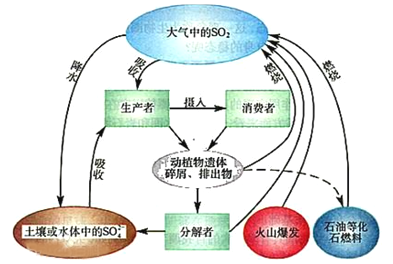
(1)硫循环与氮循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是_____
选项 | 比较 | 氮循环 | 硫循环 |
A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
B | 碳循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
(2)分解者可将含硫有机物分解为硫化氢,硫黄细菌和硫化细菌可将硫化氢进一步转变为元素硫或硫酸盐,下列关于硫化氢说法正确的是 _____________
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外层都达到8电子结构
C.将硫化氢通入硫酸亚铁溶液,产生沉淀
D.硫化氢中硫元素为-2价,因此只有还原性,没有氧化性
E.硫化氢是一种无色臭鸡蛋气味的有毒气体
(3)硫化氢虽然有毒,但有研究发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用,请再举出一例类似硫化氢“亦正亦邪”物质的实证______________________。
(4)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。收集某次酸雨样品,发现8小时内,样品pH一直在较小,其原因可能是_____________________。(用化学方程式表示)
(5)研究发现,空气其中少量的NO2也能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用不符的是___________(多选)
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入萤石中,加热
D.向盐酸中加入浓硫酸产生白雾
(6)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______。

(7)若采用如图所示的流程处理则气体a是_______________,Y一定含有______________。(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】下面提到的情况中,与盐的水解有关的是
①明矾和FeCl3可作净水剂②为保存FeCl3溶液,要在溶液中加少量盐酸③实验室配制AlCl3溶液时,应先把它溶解在盐酸中,而后加水稀释④NH4Cl溶液可作焊接中的除锈剂⑤实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂⑦在NH4Cl或AlCl3溶液中加入金属镁会生成氢气⑧草木灰与铵态氮肥不能混合施用⑨加热蒸干AlCl3溶液得到Al(OH)3固体
A.①④⑦ B.②⑤⑧ C.③⑥⑨ D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现某些金属离子如 Fe3+、Cu2+等对H2O2的分解也具有催化作用,为了比较 MnO2与 Fe3+和Cu2+的催化效果,某同学设计了如图甲、乙所示的实验。
请回答相关问题:
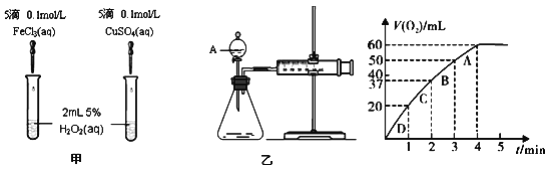
(1)定性分析:图甲可通过观察__________(填写相关实验现象), 定性比较得出结论。有同学提出将FeCl3 改为 Fe2(SO4)3 或者将 CuSO4 改为 CuCl2 更为合理,其理由是______________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。检查乙装置气密性的方法是_____________,实验中需要测量的数据是___________。
(3)加入0.10mol MnO2 粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①实验时放出气体的总体积是_______mL, 反应放出气体所需时间约为_________min。
②A、B、C、D各点反应速率快慢的顺序为 D>C>B>A.解释反应速率变化的原因:______________。
③计算 H2O2 的初始物质的量浓度为__________mol/L。(保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法错误的是( )
A. 油脂的种类很多,但它们水解后都一定有一产物相同
B. 淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体
C. 已知CH4+H2O![]() CH3OH+H2,该反应的有机产物是无毒物质
CH3OH+H2,该反应的有机产物是无毒物质
D. C(CH3)4的二氯代物只有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com