
科目: 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
A.m+n>p B.m+n<p
C.平衡向正反应方向移动 D.C的质量分数增加
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质之间的转化关系如图所示。下列说法正确的是

A. 原子半径:X
B. 非金属性:X>Y>Z
C. W、X、Y、Z四种元素可形成离子化合物
D. q与s均为酸性氧化物,m的水溶液显酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香族化合物A的水溶液呈酸性,测得A分子中无酚羟基。A可发生下图所示转化,其中F为五元环状化合物;G可使溴的四氯化碳溶液褪色;F和G互为同分异构体;H和I都是医用高分子材料。

请回答:
(1)E中的官能团名称是羟基、 。
(2)③的反应类型是 。
(3)②的化学方程式是 。
(4)A与H的结构简式分别是 、 。
(5)D与足量X溶液反应后可得到C7H5O3Na,则X溶液中所含溶质的化学式是 。
(6)符合下列条件的G的同分异构体中有一种具有反式结构.该反式结构是 (用结构简式表示)。
①能发生水解反应
②分子中不含环状结构
③核磁共振氢谱显示分子中有4种不同化学环境的氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
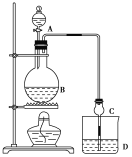
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是_______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________________;反应结束后D中的现象是____________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化铜是一种常用试剂。如:利用新制氢氧化铜验证乙醛的还原性。
(1)新制氢氧化铜悬浊液的配制:在试管里加入10%的氢氧化铜溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡。这样操作的目的是________________________。
(2)下面是某研究性学习小组开展的探究性学习活动:
提出问题:对“乙醛与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,进行了如下探究:
提出猜想:________________________。
查阅资料:①氧化亚铜属于碱性氧化物;
②+1价的铜离子在酸性条件下易发生自身氧化还原反应;
③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硝酸中,观察是否有残渣;
方案3:称取该红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次,直到固体恒重,称得质量为bg,比较a、b的大小;
方案4:取红色沉淀放于大试管里,加入酸化的硝酸银溶液,观察是否有银白色的银析出。
你认为合理的方案是____________。
(3)质量分数为11.6%的某饱和一元醛水溶液5g,跟足量新制的Cu(OH)2悬浊液反应,生成Cu2O1.44g。这种醛是________,结构简式为________。它与足量新制Cu(OH)2悬浊液反应的化学方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中
A.一定有SO42- B.可能有SO42- 或Ag+ C.一定无Ag+ D.还可能有CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们 ( )
A.溶解、过滤
B.制成热饱和溶液,降温后再过滤
C.加热、冷却后蒸发
D.溶解、过滤后结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10 mL 0.1 mol/L的醋酸溶液中加水稀释并达到新平衡后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.平衡时,溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液的pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业、生产、生活中具有非常重要的作用。下图是从铝土矿中制备铝的工艺流程:

已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3、MgO杂质;回答下列问题:
I、(1)铝土矿加入盐酸过滤后所得滤渣A的主要成分为____________。
(2)在工艺流程中,加入足量氢氧化钠溶液发生的离子反应共有_________个,其中发生沉淀溶解的离子反应方程式为____________。
(3)邋入过量的二氧化碳时,生成沉淀的离子方程式为____________。
(4)电解氧化铝,每生成1molA1时,生成____g氧气。
Ⅱ、测铝土矿组分的质量分数。
(1)若铝土矿样品质量为m,对滤渣A洗涤、干燥后称重为m1;对滤渣B洗涤、干燥、灼烧后称重为m2,该方案能测得质量分数的成份且相应的质量分数是____________;
(2)洗涤滤渣A后的洗涤液是否需加入到第一次过滤后的滤液中_____(“是”或“否”);检测滤渣A是否洗涤干净的方法是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
则H2将NO2还原为N2的热化学反应方程式:__________________
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH= —99kJ/mol。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH= —99kJ/mol。请回答下列问题:

①图中A点表示: ;C点表示2mol SO3(g)的总能量。E所代表的能量是 ;E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中△H= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com