
科目: 来源: 题型:
【题目】能把Na2SO4、NH4NO3、KNO3、(NH4)SO4四瓶无色溶液加以区别的一种试剂是(必要时可以加热)
A. BaCl2 B. NaOH C. Ba(OH)2 D. AgNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.甲烷是目前使用量非常大的一种清洁燃料。
(1)甲烷的电子式为_________,空间构型为__________,二氯甲烷的结构共有_____种。
(2)标准状况下,2.24L甲烷完全燃烧生成液态水和二氧化碳气体时可以放出89.1kJ的热量。请写出甲烷完全燃烧的热化学方程式_________________________________________。该燃烧反应也可设计成燃料电池,则通入甲烷的一端应该为原电池的______极。
II.1molH2(g)和1mol Cl2(g)在一定条件下反应生成2 mol HCl(g),放出184.5KJ的热量,已知断裂1molH2(g)中的H-H和1mol Cl2(g)中的Cl-Cl分别需要吸收436.4KJ和242.7KJ的能量,则1mol HCl分子中的化学键形成时释放_________KJ的能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+ O2(g)![]() 2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
A. 达到反应限度时,生成 SO3 为2 mol
B. 达到反应限度时,反应放出 197 kJ 的热量
C. 达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D. 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如下图。则下列判断错误的是
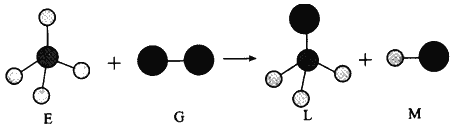
A. 常温常压下,E是一种无色无味的气体 B. 干燥的G能漂白有色物质
C. 在光照条件L能与 G继续发生与上述类似的反应 D. 上述反应类型是取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图。下列有关说法错误的是

A. a极为负极,电极上发生氧化反应
B. 电池总反应可表示为:2H2+O2=2H2O
C. 外电路中电子由b电极通过导线流向a电极
D. 该装置工作时把电能转化为化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】(11分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡的时间是 ,理由是 。
(2)右图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
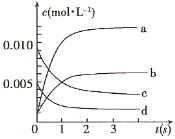
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2) = 2v(O2) b.容器内各物质的浓度保持不变
c.v逆(NO) = 2v正(O2) d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的锌片与浓度为1mol/L的足量盐酸反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A. 再加入10mL浓度为1mol/L的硫酸溶液 B. 加入几滴氯化铜溶液
C. 加入少量硝酸钠溶液 D. 加入少量氯化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com